11. REGULACIÓN DEL SISTEMA INMUNE
El sistema inmune requiere de un estricto control y autorregulación al objeto de que su funcionamiento sea lo más eficiente y ajustado a las necesidades defensivas de cada momento. De los muchos aspectos que requieren ser regulados destacan dos. El primero es la necesidad de respetar a los componentes propios del organismo donde asienta, porque esto implicaria un claro riesgo para la vida, pues, de no darse esta circunstancia, conocida como tolerancia inmunológica, el sistema inmune en lugar de ser nuestro defensor se convertiría en nuestro enemigi.
Analizaremos por separado estos dos aspectos, la tolerancia inmunológica y el control de la respuesta inmune.
Tolerancia Inmunológica
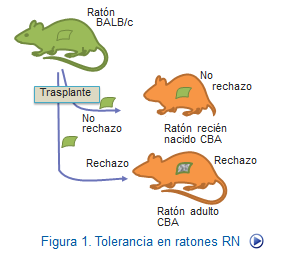
Conocer las bases moleculares y celulares de la tolerancia inmunológica no ha sido tarea fácil y ha costado un gran esfuerzo investigador.Todo comenzó cuando Medawar demstró que la capacidad de aceptar un injerto puede inducirse en animales recién nacidos y además que esta propiedad puede permanecer durante largo tiempo. Así Medawar, pudo concluir que el fenómeno de aceptación de injertos de piel en ratones se debe a un estado especial, que denominó tolerancia inmunológica.
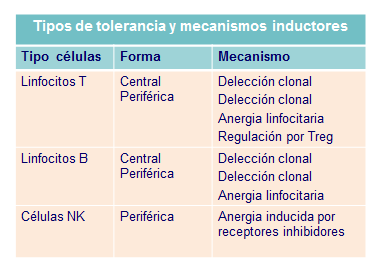
Hoy sabemos que la tolerancia forma parte consustancial de la respuesta inmune e incluso conocemos sus características, que se pueden resumir en cuatro puntos: especificidad frente a cada antígeno, que es de carácter duradero y que se induce en el proceso madurativo de los linfocitos, tolerancia central, pero también en linfocitos ya maduros a nivel periférico,tolerancia periférica. Todo ello par evitar reacciones de autodestrucción del organismo por linfocitos autorreactivos donde asientan (Tabla: Tipos de tolerancia).
Tanto los linfocitos T como be, tienen mecanismos de tolerogenización distintos, que analizaremos seguidamente.

Al poseer los linfocitos T capacidad de producir citocinas que actúan sobre una gran variabilidad de células, hace que la tolerogenización de estas células sea esencialmente importante.
Tolerancia central linfocitos T.
Tolerancia periférica linfocitos T.
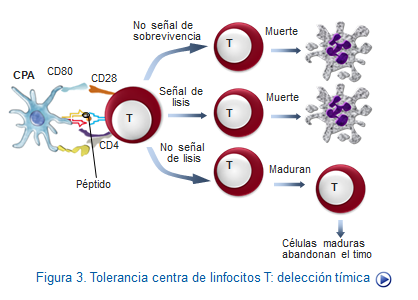
En el timo el proceso de delección de clones autorreactivos no puede ser exhaustivo ya que se puede reducir dramáticamente el repertorio de linfocitos T disponible para responder a los antígenos ajenos, por lo que se mantienen en circulación ciertos clones capaces de reconocer antígenos propios de los tejidos "periféricos" (Figura: Tolerancia T periférica).

Ignorancia clonal a linfocitos T. Se entiende por ignorancia clonal el mecanismo por el cual los linfocitos T no detectan la presencia de células propias. Se incluye como una situación especial pero que en realidad no corresponde con una situación de tolerancia puesto que no ha habido ningún elemento inductor. Esto es por ejemplo lo que ocurre por la presencia de barreras anatómicas interpuestas entre las células del organismo y los linfocitos T autorreactivos. El resultado es que los clones autorreactivos se mantendrán indiferentes frente a células que, si bien contienen antígenos reconocibles por ellos, se encuentran aislados y por tanto inmunológicamente ausentes.
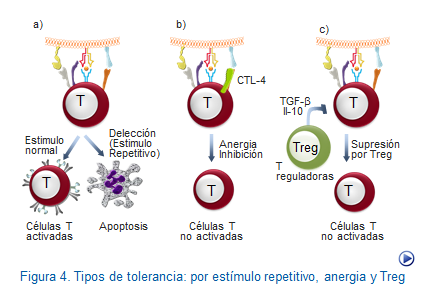
Anergia de clonos T autorreactivos. Se ha demostrado que algunos linfocitos T circulantes autorreactivos no proliferan en respuesta a ciertos autoantígenos se denomina anergia. Se cree este fenómeno aparece como consecuencia de una activación incompleta de los linfocitos por falta de una segunda señal. Esto se debe a que esta segunda señal, sólo se produce cuando las células presentadoras de antígenos interactúan con los linfocitos T después de reconocer agentes patógenos. De modo que si esto no sucede y están presentando exclusivamente antígenos propios no expresarán moléculas coestimuladoras y los linfocitos que reconozcan los péptidos propios en ausencia de esta moléculas, quedan en una situación de no respuesta, anergia, ante ulteriores estímulos.
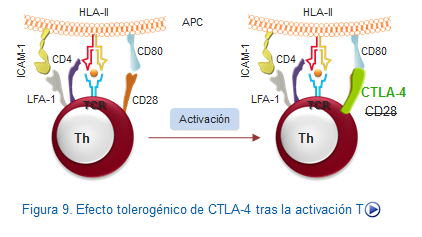
Un caso especial de la anergia es cuando la inhibición clonal ocurre después del momento en el que la estimulación se pone en marcha, y una serie de mecanismos reguladores que terminan por inhibir la proliferación del clon correspondiente. De entre estos mecanismos inhibidores el más conocido es aquel en el que interviene la molécula de superficie CTLA-4 (cytotoxic-T-lymphocyte associated protein 4) también denominada CD152. Ello se debe a su mayor afinidad por el CD80, que es el ligando del CD28 y a su acción inhibidora de todo, lo cual veremos más extensamente en el apartado dedicado a la regulación del sistema inmune.
Eliminación de clonos T autorreactivos. Se trata de la muerte de linfocitos mediante apoptosis con lo cual desapareen ciertos clonos autorreactivos, delección clonal, con lo cual ocurre generalmente en dos situaciones: una en la que debido a estímulos insuficientes de los linfocitos por carencia de coestímulo, estos pueden producir ciertas proteínas que producen la muerte linfocitaria vía mitocondrial. La segunda posibilidad es por una sobre estimulación de los linfocitos, tal como puede ocurrir en las fases finales de la respuesta inmune frente a un patógeno, los linfocitos adquieren la capacidad de sintetizar FAS, que al unirse al FASL se desencadena un proceso de destrucción de estos linfocitos por apoptosis (Figura: Tipos de tolerancia T).
Acción mediada por células T reguladoras. El descubrimiento por Gershon de que en el curso de la respuesta inmune se genera actividad supresora, es decir, mediadores capaces de inhibir la reacción inmunológica en marcha, llevó a la especulación sobre la existencia de células T con actividad supresora de la respuesta inmune.
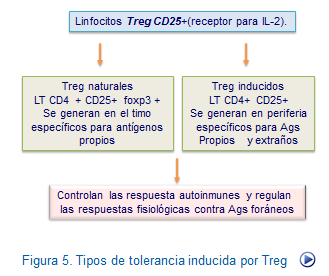
Células Treg naturales. Estas células que se caracterizan por ser CD4+CD25+ FOXP3 +, dependientes de IL-2 y desempeñan un papel central en el mantenimiento de la tolerancia a nivel periférico frente a antígenos propios. Representan un 10 % de los linfocitos T CD4+ y su ausencia se asocia con la presencia de enfermedades de tipo autoinmune. Su acción consiste en inhibir la producción de citocinas por las células Th1, Th2 y CTL mediante la liberación de IL-10 y TGF-beta (Figura: Tolerancia por Treg).
Células Treg de tipo inducible. Son células CD4+CD25+ que se generan a nivel periférico y tiene como función bloquear al sistema inmune frente a antígenos propios y extraños, de ahí su nombre de inducibles. Pueden ser de dos tipos: Células reguladoras productoras de IL-10 y células productoras de TGB-beta que se caracterizan y TGB-beta, respectivamente. Ambas poseen la capacidad de inhibir linfocitos T colaboradores y T citotóxicos.
Células T reguladoras Th17. Estas células productoras de la citocina 17 han demostrados ser cruciales controlando la inflamación y las enfermedades autoinmunes por mecanismos muy flexibles y adaptables a cada circunstancia.
Tolerancia linfocitos B
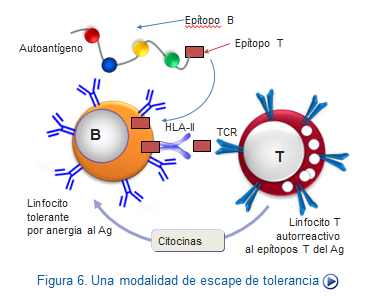
Los linfocitos B, al igual que los T, adquieren funciones tolerogénicos evitando producir anticuerpos contra los componentes propios. Sin embargo, como los linfocitos B requieren para su activación, el apoyo de citocinas producidas por los linfocitos T, si ya los T son tolerogénicos dificultan la acción a los B. En todo caso la tolerancia B, tanto central como periférica intervine de manera importante evitando enfermedades autoinmunes, sobre todo en las personas mayores.
Afortunadamente, estas células B son controladas mediante mecanismos de inducción de tolerancia en los tejidos periféricos evitándose así complicaciones, tales como enfermedades autoinmunes.
Tolerancia B periférica
Entre los linfocitos B circulantes son muy numerosas las células capaces de reconocer auto antígeno. Afortunadamente linfocitos B autorreactivos, en su mayoría, no se activan por si solos ya que requieren señales en forma de citocinas proveniente de las células T colaboradores, cuyo repertorio es mucho menos autorreactivos y está mucho más regulado.
La alta frecuencia de linfocitos B autorreactivos se explica porque éstos no sufren un proceso de selección negativa tan riguroso como el de los linfocitos T en el timo y de hecho se ha postulado que la autorreactividad B ‑de baja afinidad‑ es normal. Además la generación de diversidad de los receptores (Ig) de los linfocitos B incluye un mecanismo, hipermutación somática, que actúa en el curso de la respuesta inmune y que, expandiendo de nuevo el repertorio, puede generar autoanticuerpos de alta afinidad.
Mecanismos de escape a la tolerancia
A pesar de los múltiples mecanismos, tanto centrales como periféricos, encargados de inducir y mantener la tolerancia inmunológica, en muchos casos fallan y consecuentemente dan lugar a enfermedades autoinmunes. Existen diversas circunstancias que explican este fenómeno de ruptura de tolerancia. Entre ellas destacan:
1. La imposibilidad de contacto de células inmunocompetentes con autoantígenos que normalmente no son accesibles al sistema inmune, como ocurre en situaciones de daño tisular por ejemplo postraumático o inflamatorio.
3. Activación masiva de linfocitos T o B, como consecuencia de infecciones. Por ellos muchas infecciones se consideran elementos causantes o coadyuvantes en etiopatogenia de enfermedades autoinmunes, como la esclerosis múltiple o la diabetes tipo I. Dentro de este grupo se pueden considerar al menos tres supuesto distintos inductores de enfermedades autoinmunes por infecciones.
1. Cuando se activa un gran número de clones por superantígenos, generalmente presentes en bacterias.
2. Al aumentar la cantidad de citocinas activadoras e incluso de moléculas coestimuladoras por infecciones intercurrentes.
3. Cuando hay similitud estructural de antígenos presentes en patógenos y autoantígenos, mimetismo molecular, lo que haría que la respuesta inmune generada por los patógenos durante una infección reconoce a antígenos propios y por tanto pueden atacar a antígenos propios.
¿Cómo se induce tolerancia inmunológica?
Hasta ahora el único remedio terapéutico disponible para estas situaciones era provocar una inmunosupresión generalizada e inespecífica. Esto aunque mejora el curso de las enfermedades de tipo autoinmune e incluso la supervivencia de órganos trasplantados, tiene el inconveniente de dejar al individuo en una situación de parálisis inmune que a su vez puede ser causa del padecimiento de enfermedades infecciosas. Por ello, los esfuerzos actualmente van encaminados a producir tolerancia selectiva frente a los componente deseados en cada momento, con lo cual se evitan los efectos colaterales tan indeseados.
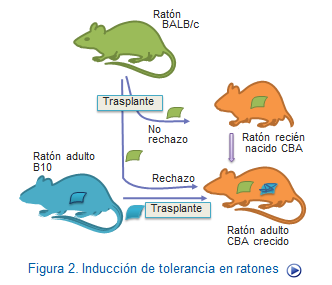
Sin embargo, hoy sabemos que aunque la tolerancia se estableció fundamentalmente en el sistema inmune inmaduro del feto o del animal recién nacido, recientemente se ha demostrado que es posible inducir tolerancia en animales adultos. Esta posibilidad ha despertado obviamente un gran interés por su aplicación práctica en clínica humana, especialmente en el campo de la reumatología y de los trasplantes de órganos.
Los experimentos pioneros demostrativos de la inducción de tolerancia en adultos fueron realizados por Mitchinson en Inglaterra, quien demostró efectos tolerogénicos relacionados con el:
1. Forma de administración del antígeno. Así la inyección endovenosa previa durante varios días de un antígeno soluble podía inducir, según la dosis administrada, tolerancia a inyecciones posteriores del mismo antígeno. También se ha demostrado que 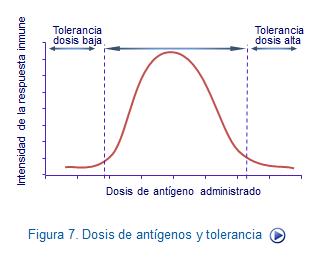
2.Cantidad de antígeno administrado. Sabemos como dosis muy bajas o muy altas de antígenos inducen tolerancia mientras que existe una dosis media que depende de cada uno de los antígenos, que son capaces de inducir respuestas inmunes intensas (Figura: Ag y tolerancia).
3. Características fisicoquímicas del antígeno. Los antígenos apolares y solubles son más tolerogénicos, al igual que ocurre con antígenos de peso molecular inferior a 6000 Dalton, probablemente porque difícilmente atraen a las células presentadoras de antígenos.
4. Tratamiento con IL-2. En este caso se genera una activación incompleta (sin segunda señal) generando en consecuencia anergia de los linfocitos.
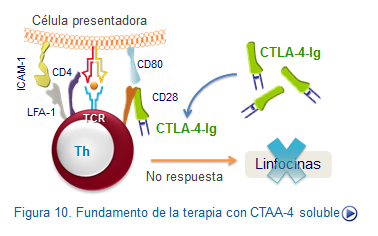
6.Bloqueo de moléculas coestimuladoras. La estrategia de bloqueo de moléculas estimulantes se suele utilizar para bloquear la respeta inmune en situaciones clínicas graves. Uno de estos procedimientos es el bloqueo del receptor CD28 por CD80, administrando CTLA-4 recombinante fusionado a un dominio de inmunoglobulina (CTLA-4Ig), como veremos al final de este capítulo. El bloqueo de la coestimulación asociado a determinadas terapias inmunosupresoras está abriendo la posibilidad de inducir tolerancia duradera en pacientes trasplantados, lo cual permitirá disminuir, e incluso interrumpir a medio plazo, las terapias inmunosupresoras, evitando los efectos indeseables asociados a las mismas.
Sin embargo en la mayoría de los intentos realizados hasta ahora, mientras que la inducción de tolerancia puede prevenir en muchos casos la aparición de enfermedades autoinmunes o el rechazo de injertos, en muy pocos casos existen estrategias que permitan revertir enfermedades autoinmunes ya establecidas.
Control de la respuesta inmune
El tipo de respuesta inmune requerida en cada momento debe de ajustarse en su inicio, desarrollo y terminación a cada una de las circunstancias que la motivaron. Hoy sabemos que, para este control el individuo dispone de múltiples sistemas de auto-regulación, entre los que destacan el tipo y cantidad de anticuerpos formados, las linfocinas intervinientes, la acción de los linfocitos T reguladores, la presencia o ausencia de moléculas de tipo activador o inhibidor, la red idiotipo-antiidiotipo, moléculas de histocompatibilidad presentes en cada individuo y la influencia del sistema endocrino y nervioso entre. Veamos los aspectos más sobresalientes de cada uno de estos elementos participantes.
Papel regulador de los anticuerpos
Función reguladora de linfocinas
Las linfocinas, al actuar en la activación, proliferación o diferenciación de las células inmunocompetentes, intervienen de una manera diferente regulando la respuesta inmune. Esta función es tanto más atrayente en cuanto que pueden actuar bien facilitando o bien inhibiendo los proseos en los que intervienen. En concreto, algunas linfocinas poseen unos efectos inhibidores como son la IL-10 y el TGF-beta sobre la respuesta inmune, mientras como la IL-2, lo hacen activando la proliferación.
Función reguladora de linfocitos Treg
Los linfocitos Treg ejercen un importante papel regulando la respuesta inmune, con la intervención de los tres tipos de células T reguladoras, ya estudiadas en este capítulo.
Función reguladora de moléculas activadoras e inhibidoras
En cada uno de los escalones de la respuesta inmune intervienen receptores con función activante de las células inmunocompetentes, tales como el TCR, CD28, etc. y también receptores cuya acción es inhibitoria, como es el caso de los receptores ILT-2, KIR2DL, moléculas CTLA-A (Cytotoxic T-Lymphocyte Antigen 4) y PD-1 (Programmed Death 1), etc
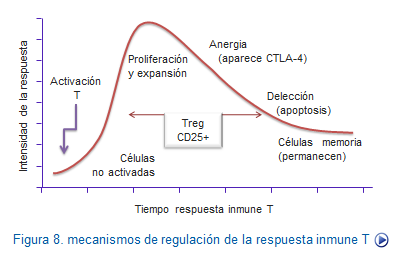
Además, es conocido como a lo largo de una respuesta inmune frente a un estímulo, después de una fase de máxima expansión celular, se produce otra en la que van despareciendo muchas de las células formadas (delección). En este declive interviene las células Treg e inductoras del proceso de apoptosis y muerte, con lo cual disminuye la cantidad de células, quedando sólo las células memoria (Figura: Regulación T).
Otro mecanismo de regulación inmune relevante, se descubrió al observarse que determinantes antigénicos configurados por las partes variables de las cadenas pesadas y ligeras de las inmunoglobulinas (idiotipos) pueden constituir en sí un amplio repertorio de autoantígenos. Estos autoantígenos se encuetan normalmente en muy pequeña cantidad para ser identificados por el sistema inmune, pero cuando un determinado clon es estimulado por su antígeno, el sistema inmune ya no puede ignorarlo y produce segundos anticuerpos (anti-idiotipo), que reconocería a dicho antígeno y tendrían además un efecto modulador que puede ser positivo o negativo. A este proceso se le denominó, teoría de la red de anticuerpos, (Figura: Teoría del idiotipo-antiidiotipo).
Inmuno-regulación del sistema nerviosos y endocrino.
Es de destacar que el sistema inmune no trabaja aisladamente, sino que lo hace coordinadamente con otros sistemas del organismo y principalmente con el sistema nervios y el sistema endocrino. La conexión sistema inmune y nervioso ha sido después ampliamente demostrada en ambas direcciones de tal manera que, en su conjunto, se mantiene la homeostasis del organismo de una forma integrada con participación de los sistemas inmune, nervioso y el endocrino. De ahí que se encuentre en permanente expansión una nueva área de la ciencia conocida como neuro-inmuno-endocrinología (Figura: Interacción diferentes sistemas).
Así, el sistema nervioso que es receptor de múltiples estímulos, entre los que destacan los de estrés, y responde a los mismos mediante mediadores, como neurotransmisores y hormonas, llegan al sistema inmunitario sobre el que pueden actuar a través de las hormonas adrenalina y glucocorticoides. Todo esto puede demostrar algo que se conoce ya a nivel general y es que el estrés continuado deteriora al sistema inmune probablemente por acción directa de dichas hormonas, adrenalina y cortisol que tiene acción inmunosupresora.
Para hacer posible esta rica interacción muchas de las células de estos tres sistemas, inmune, endocrino y nervioso, poseen receptores que reconocen tanto a linfocinas, neurotransmisores y hormonas. De esta manera, las linfocinas, producidas mayoritariamente por el sistema inmune pueden ser reconocidas por células tanto del sistema nervioso como endocrino. De igual manera podemos decir de las hormonas, muchas de las cuales son reconocidas por el sistema inmune y nervioso, al igual que ocurre con los neurotransmisores que pueden ser reconocibles por células inmunocompetentes y endocrinas (figura: interrelaciones entre el sistema inmune, nervioso y endocrino)
Función reguladora de las moléculas HLA
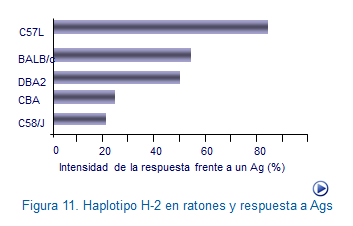
El hecho concreto es que cada individuo responde de manera única y distinta frente a estímulos iguales. Esto fue originalmente demostrado en ratones con diferentes haplotipos de histocompatibilidad (H-2) en los que se observó que respondían de manera desigual aunque se les administrase un mismo antígeno. Así, a ciertos antígenos sintéticos responden de manera más intensa los ratones C57L que los BALB/c/ o los CBA (Figura: H-2 y respuesta Ags).
Esta manera diferente de responder a antígenos está claramente establecida en humanos. Por ejemplo existe en los individuos heterocigotos para HLA la infección de sida progresa de manera más rápida que los homocigotos. O que individuos HLA-B57 positivos poseen la cualidad de desarrollar más lentamente la enfermedad de sida. De esta manera podríamos ir citando interminable lista de casos demostrativos de la influencia de las moléculas HLA en el desarrollo de la expuesta inmune.
Antes de terminar este capitulo, hemos de indicar que a pesar del gran avance en el conocimiento de los procesos moleculares subyacentes del sistema inmune, aún nos hallamos lejos de comprender con detalle cómo se regula la respuesta inmune y más lejos aún de entender el funcionamiento global del sistema inmune.
Muestra de este desconocimiento es la gran cantidad cuestiones que quedan por resolver tales como ¿Qué hace que se desregule la inmune?, ¿Por qué el sistema es a veces nuestro peor enemigo? Preguntas que dejamos en el aire esperando nuevos datos que aclaren estas cuestiones.
Bibliografía
- MaciánF & García-Cózar F, Im SH, Horton HF, Byrne MC, Rao A. Transcriptional mechanisms underlying lymphocyte tolerance. Cell 2002, 109:719.
- Kamradt T, Mitchison NA. Tolerance and autoimmunity. N Engl J Med. 2001, 344: 655.
- Mellor AL, Munn DH. IDO expression by dendritic cells: tolerance and tryptophan catabolism. Nat Rev Immunol. 2004, 4: 762-74.
- Muller CA, Autenrieth IB, Peschel A. Innate defenses of the intestinal epithelial barrier. Cell Mol Life Sci. 2005, 62: 1297-307.
- Hornef MW, Bogdan C. The role of epithelial Toll-like receptor expression in host defense and microbial tolerance. J Endotoxin Res. 2005, 11: 124-8.