10. ACCIONES DEL SISTEMA INMUNE
El sistema inmune efector está formado por células inmunocompetentes que están especializadas en reconocer y destruir otras células consideradas como extrañas y microorganismos patógenos. De esta manera el sistema inmune nos defiende de células infectadas por virus, células que han perdido los caracteres de identidad propia, células tumorales o microorganismos patógenos que nos invaden. Entre las células que poseen esta función lítica/destructora (citotóxcia) destacan: Linfocitos T citotóxicos (CTL ), Células asesinas naturales (NK) y Macrófagos y neutrófilos.
Lisis por linfocitos T citotóxicos
Reconocimiento de CTLs
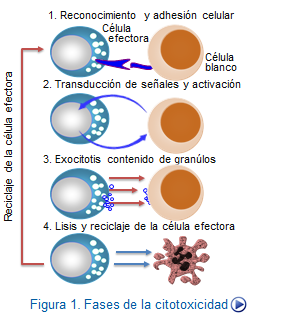
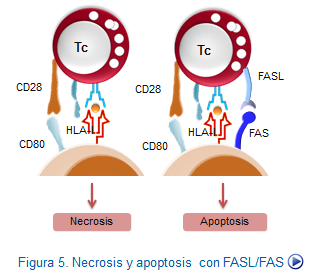
El proceso de reconocimiento y adherencia entre las CTLs y las células blanco es sustancial. En primer lugar, es necesaria la unión del complejo TCR/CD3 dela CTL con sus ligandos HLA clase I y el péptido correspondiente en la célula diana. Además, se requiere la presencia de moléculas CD28 y sus ligandos CD80, que proporcionarán el coestímulo necesario para el inicio de la transducción de señales. Moléculas de adhesión, tales como el LFA-1 y su ligando, se encargan de estabilizar el contacto intercelular al unirse a sus ligandos en la superficie de la célula diana. Tambien es necesario un incremento del número de receptores de citocinas, especialmente de la IL-2 que propiciará el apoyo necesario para la proliferación celular (Figura: Lisis CTL/NK).
Activación de CTLs
Posteriormente a las interacciones celulares indicadas, se produce la activación de las células CTLs que se hacen evidentes en 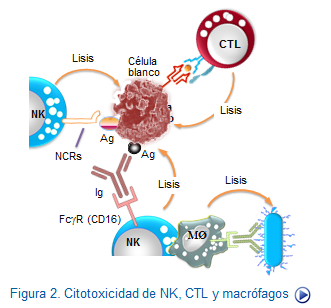
1. La reorganización del citoesqueleto, con localización del centro organizador de microtúbulos (MTOC) y de los centriolos próximos a la zona de contacto intercelular.
2. La polarización del aparato de Golgi y de los gránulos de secreción en la misma zona.
3. Fusión de los gránulos con la membrana plasmática, que permitirá la posterior exocitosis de su contenido al espacio intercelular.
4. La secreción de ciertas citocinas, particularmente IFN-gamma y TNF-alfa que son importantes mediadores de la citotoxicidad.
5. Facilitación de la expresión de la molécula Fas ligando (FasL) en las células efectoras. Esto permitirá que después sea posible su unión con las moléculas Fas presentes en las células diana, lo que posibilita el desarrollo del proceso lítico que estudiaremos a continuación.
Fase lítica de CTLs
En esta fase trataremos los fenómenos líticos utilizados por las ceúlas CTL, que en su esencia son los mismos que los que utilizan las células NK. Esta acción es compleja, tanto para células T como para las NK y requiere un estricto control, puesto que un error en ello podría conducir a la destrucción de las propias células del organismo, lo que sería indeseable y caótico. En este proceso destaca la liberación de factores lítico/citotóxicos, tales como perforina y granzimas, de los gránulos donde se encuentran almacenados.
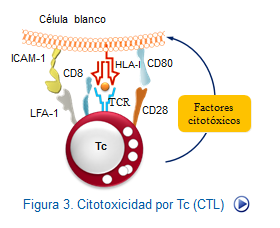
En el inicio de este proceso lítico interviene, ademas de las moléculas TCR y sus ligandos (HLA + Ag) y la pareja B7 y CD28, el ligando FAS (FASL) muy abundante en la membrana de las células efectoras después de su activación. Este ligando interactúa con las moléculas FASde la célula blanco,iniciando una vía lítica de gran importancia.
Finalmente, el proceso conduce a la muerte celular por un mecanismo conocido como apoptosis, que se caracteriza por la ruptura del DNA de las células blanco en múltiples fragmentos.
Acción de la perforina y granzima
Tanto las moléculas de perforina como de granzima, se encuentran almacenadas en gránulos de donde serán liberados cuando se desarrollen los procesos proteolíticos. Los gránulos son estructuras con un núcleo electrodenso y poseen pH ácido. Cuando se produce la activación de las células efectoras (CT o NK), estos gránulos salen del linfocito y vierten en la membrana de la célula diana su contenido, tanto de granzima como de perforina.
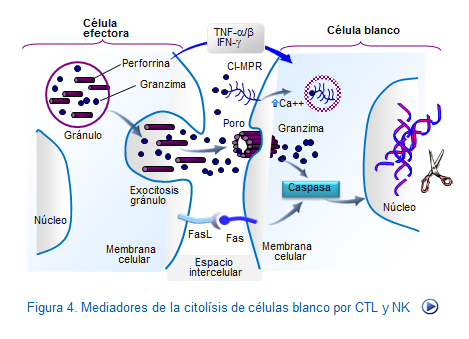
Como Granzima, se conocen ciertos componentes, todos ellos con actividad serina esterasa, que se encuentran específicamente en los gránulos de los linfocitos citotóxicos. Como perforina o proteína formadora de poros (PFP) se conocen unas moléculas que se localizan en los gránulos, y que presentan la propiedad de interaccionar con fosfolípidos de la membrana plasmática. Cuando se produce (como consecuencia de la activación celular) la liberación del contenido de los gránulos de los linfocitos citotóxicos sobre la membrana plasmática de la célula diana, la perforina entra en contacto con el calcio intercelular y polimeriza.
La polimerización de varias subunidades de perforina forma estructuras tubulares, identificables por microscopía electrónica, que constituyen canales y aumentan la permeabilidad de la membrana plasmática. Estos poros formados por la perforina hacen que la célula diana sea incapaz de regular los la concentración iónica, produciendo un desequilibrio osmótico que conduce a su lisis.
Por estos poros penetra también la granzima en las células diana, ejerciendo así su efecto citotóxico. También en este proceso citolítico intervienen el TNF α y β y el IFN-γ. (Figura: Citotoxicidad CTL)
Acción del Fas y FasL
Desde los estudios de Russell se sabe que en las células diana, en el proceso de lisis celular, se produce una degradación del ADN en múltiples fragmentos antes, incluso, de que ocurra la permeabilización de la membrana plasmática.
Este proceso de apoptosis consta de dos fases:
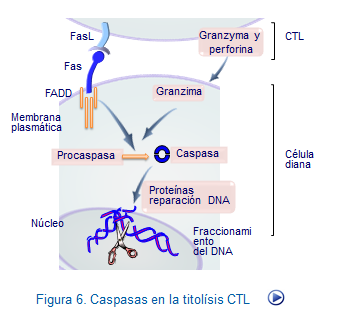
1-Una fase primera en la que la célula se programa para morir, activándose las enzimas proteolíticas encargadas del proceso, denominadas caspasas. La proteína transmembrana, Fas, una vez se ha unido su ligando FasL, interactúa con un factor intermedio denominado FADD (factor associated death domain) activando el complejo cisteinil-aspartato proteasas (caspasas). De igual manera interviene el TNF, que al interactuar con el TNFR-1, participa también activando las caspasas. Se han descrito 11 caspasas en células humanas que provocan una degradación proteica bien definida hasta llegar a los cuerpos apoptóticos. Algunas caspasas son "iniciadoras" y otras son "efectoras" del proceso catalítico, actuando sobre otras proteínas directamente responsables de la fragmentación del ADN, las endonucleasas. Mientras el Fas no está unido a su ligando, esta vía permanece inactiva.
La puesta en marcha de la vía de las caspasas culmina con el fraccionamiento del DNA y muerte celular en un proceso que se denomina muerte por apoptosis (Figura: Apoptosis por CTL).En el núcleo se degrada el ADN y se hacen visibles condensaciones de cromatina nuclear, formándose aglomeraciones que se desplazan hacia la superficie de la membrana nuclear. La muerte celular se produce después de grandes alteraciones nucleares, de la membrana plasmática y de las mitocondrias.
Una vez han muerto las células, éstas sonreconocidas como células seriamente deterioradas, siendo fagocitadas por los macrófagos que actúan como células limpiadoras del organismo, reconociendolas de manera inespecífica.
Fase lítica de NK
Efectivamente, la lisis mediada por las células NK puede ser de dos formas en cuanto al sistema de reconocimiento utilizado. Una, es aquella en la que la célula blanco es reconocida de manera indirecta por receptores Fc y de complemento, que a su vez son las estructuras que identifican la célula blanco. La otra forma, es por reconocimiento no directo en el que participan receptores especializados que pueden ser de tipo activador o inhibidor.
En cualquier caso, el reconocimiento de las células blanco por las células NK, no está restringido por las moléculas HLA. Por otra parte, también es de destacar que a diferencia de las CTL, las células NK no guardan recuerdo de acontecimientos anteriores y por tanto no se generan células memoria de tipo NK. Sin embargo, las células NK destruyen células tumorales e infectadas por virus mediante procesos similares a los que ejercen los linfocitos T citotóxicos.
Las células NK poseen múltiples gránulos que incluyen perforina y granzimas y, además, poseen FasL en su superficie, con lo que inducen con facilidad la muerte de células blanco que poseen Fas. A diferencia de los CTL, que requieren activarse antes de la aparición de gránulos, las células NK siempre tienen gránulos en su citoplasma aunque éstos poseen mayor actividad cuando estas células son activadas con IL-2, en cuyo caso se les denomina células activada por IL-2 (LAK).
Lisis por células NKT
A pesar de que las células NKT expresan TCR, éste no reconoce péptidos, sino que reconoce glucolípidos presentados por las moléculas CD1, son unas moléculas de histocompatibilidad no clásica. Estas células expresan ciertos marcadores propios de NK, entre ellos el conocido como CD161. En definitiva, estas células, aunque se encuentran en muy bajas cantidades en el organismo, parece ser que poseen una maquinaria citolítica muy eficiente.
Lisis por monocitos y macrófagos
Los macrófagos poseen capacidad de destruir microorganismos y células extrañas o propias alteradas. Intervienen especialmente como parte de la respuesta inmune innata y también colaboran en el inicio de la respuesta inmune adaptativa presentando péptidos y produciendo citocinas relevantes.

A continuación, veremos cómo se llevan a cabo los procesos de reconocimiento, activación y lisis mediados por los macrófagos y qué comparten con los neutrófilos en sus aspectos esenciales (Figura: Fagocitosis).
Proceso de reconocimiento por macrófagos
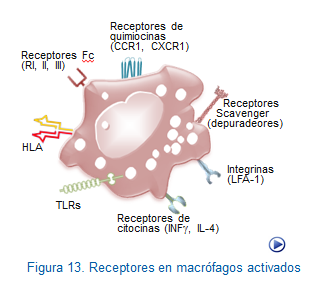
Los macrófagos y neutrófilos reconocen las sustancias extrañas, principalmente microorganismos, mediante una gran variedad de receptores. Entre estos receptores destaca un grupo de receptores iniciadores de la fagocitosis (RIF) que se caracterizan por reconcer el extremo Fc de las Igs (FcR ó CD16) o ciertos componentes derivados de la activación del complemento (CRs). Además estas célualas poseen un grupo de receptores, conocidos comopatrones moleculares asociados a patógenos (PAMPs), que se caracterizan por identificar un alto número de moléculas presentes, todas ellas, en la mayoría de los patógenos pero no en los tejidos propios del individuo. A continuación, veremos algunos aspectos específicos de estos receptores.
iniciadores de la opsonización y fagocitosis.
De los receptores Fc (FcR) destacan los FcRI y FcRIII que se caracterizan por reconocer con alta afinidad el extremo Fc de las inmunoglobulinas. Entre los receptores del complemento (CR) destacan CR1, CR2, CR3 y CR4, que se caracterizan por reconocer los fragmentos activados derivados de la degradación del complemento, C3 (C3b) y sus productos de escisión proteolíticos, C3b1, C3d y C3dg rspectivamente.
Receptores de PAMPs
Receptores tipo Toll.
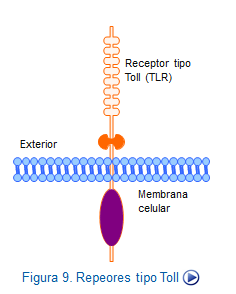
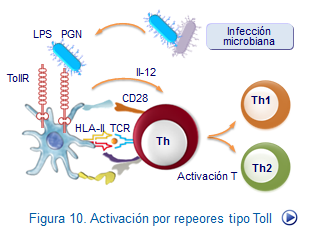
Similares a los Toll-like receptor (TLRs), se encuentran en monocitos, neutrófilos y células dendríticas y por reconocer las estructurasPAMPs, poseen la capacidad de unirse a una gran variedad de microroganismos (Figura: Activación Toll).
Se han identificado hasta el momento diez tipos, que se diferencian por reconocer diferentes estructuras dentro de PAMPS (Tabla: Receptores tipo toll en mamíferos).
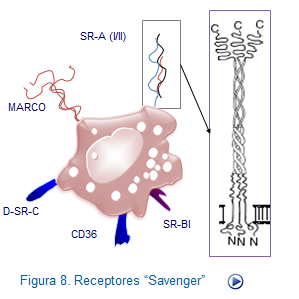
Receptores depuradores. De las estructuras PAMPs que reconocen destacanan los lipopolisacaridos y ciertos polirribonucleótidos presentes en una gran variabilidad de bacterias (Figura: Receptores depuradores).
Activación de macrófagos
Todos los receptores de los macrófagos anteriormente estudiados se unen a sus ligandos, iniciándose el proceso de fosforilación de la cola citoplasmática de muchos de ellos con lo que se activa la cascada de segundos mensajeros en los macrófagos.
Por ejemplo, en el caso de los receptores tipo Toll, se producirá la activación predominante de NF-kB, que como se sabe actúa sobre los genes controladores de la síntesis de IL-1, IL-12 y TNF, receptores de citocinas, moléculas de histocompatibilidad y la mayoría de los elementos que participan en la lisis de microorganismos patógenos. (Figura: Activación macrófagos).
Cabe destacar que este proceso de activación suele presentarse en los focos inflamatorios formando parte de la respuesta innata y que además sirve de estímulo para el inicio de la respuesta adaptativa, al ser los macrófagos unos excelentes presentadores de antígenos a los linfocitos T.
Proceso lítico de macrófagos
Una vez que los receptores presentes en macrófagos y neutrófilos reconocen a los patógenos, se inicia un proceso de activación del macrófago que conduce a la interiorización de los microorganismos mediante un proceso conocido como fagocitosis (Figura: Lisis macrófagos).
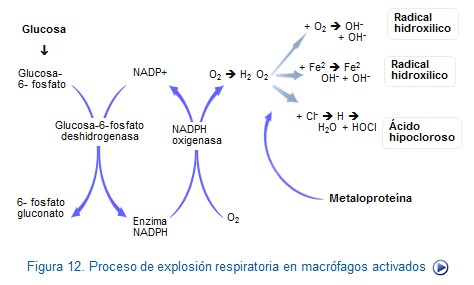
En el proceso de destrucción de las sutancias extrañas, por ejemplo patógenos, en los fagosomas de los macrófagos y también de los neutrófilos, intervienen dos sistemas de distinta naturaleza. Uno, mediado por sustancias dependientes de la producción de derivados del oxígeno, son los intermediarios reactivos de oxígeno (IRO) y el otro, mediado por susantancias independientes del oxígeno, como son ciertas enzimas y componentes con actividad bactericida.
Mediadores dependientes de Oxígeno.
Los mediadores dependientes de oxígeno se inician por la enzima NADPH oxidasa presente en la membrana de los fagosomas, que actuando sobre el oxígeno lo transforma en anión superóxido, (O2-) . Éste puede dar lugar a la formación de peróxido de hidrógeno, anión hipoclorito y radicales hidroxilo. Estos productos que se forman como consecuencia de la explosión 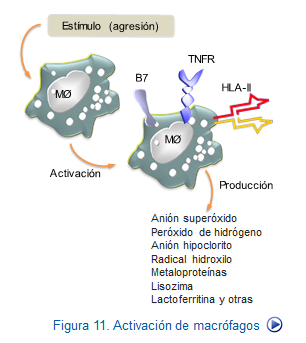
El H2O2 se puede reducir, dando lugar al radical hidroxilo (OH-) que es altamente tóxico. En el caso de que por ejemplo el H2O2 salga fuera del fagosoma, puede causar daño celular de importancia si no es destruido por una enzima citoplasmática llamada glutatión peroxidasa.
Mediadores independientes de oxígeno.
Además de los mediadores dependientes de oxígeno antes indicados, los macrófagos producen intermediarios reactivos del nitrógeno. Entre ellos destaca el óxido nítrico (NO) formado por la intervención de la enzima sintetasa inducible de óxido nítrico (NOSi) que se activa como respuesta a productos bacterianos, principalmente cuando actúa el IFN-gamma. En el interior de los fagosomas el óxido nítrico puede combinarse con el peróxido de hidrógeno o con superóxidos generando peroxidonítritos que poseen una gran capacidad destructiva de microorganismos patógenos.
En resumen, son numerosos y muy variados los mecanismos microbicidas utilizados por macrófagos y por neutrófilos. Básicamente, tras contactar los microorganismos con los macrófagos o con neutrófilos, son reconocidos por los sus receptores presentes en la membrana, fagocitados y destruidos con la intervención de mediadores dependientes o independientes del oxígeno.