09. EL COMPLEMENTO Y SUS ACCIONES
Se conoce con el nombre de complemento al conjunto de proteínas que actúan, cuando se activan y que tienen como fin último defender al organismo, esencialmente de microorganismos.

El complemento es un sistema muy eficiente para luchar contra las infecciones. Una vez iniciado se produce una amplificación progresiva de las reacciones que lo convierte en un fenómeno imparable hasta que consigue el objetivo de aniquilar al microorganismo que lo puso en marcha.
¿Cómo se activa el complemento?
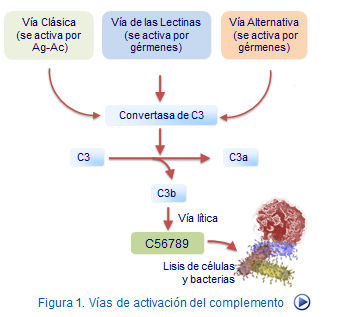
La activación del complemento implica cambios en ciertos componentes que dan lugar a reacciones en cadena, de forma que se van generando productos activos que tienen acciones biológicas importantes en la defensa del organismo. Todo ello debido a que muchos de los factores del complemento son enzimas con carácter proteolítico (Figura 1).
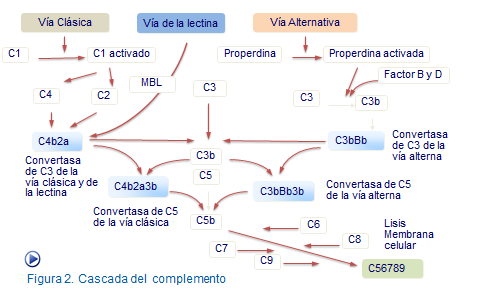
La activación del complemento puede iniciarse de tres formas distintas dando lugar, a su vez, a tres formas diferetnes de reacciones y que se conocen como vía clásica, vía alternativa y vía de las las lectinas Todas estas formas confluyen en una única ruta final conocida como vía lítica (Figura 2).
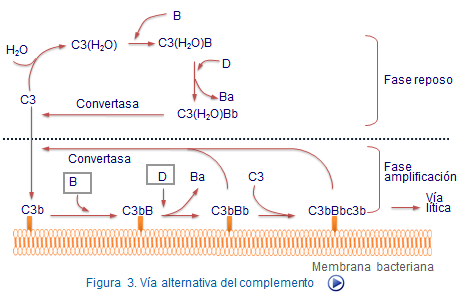
Vía alternativa
Esta vía se inicia directamente por componentes de las membranas bacterianas y no necesita la presencia de anticuerpos. Por ello, representa un mecanismo de defensa importante en los estadios iniciales de la infección, cuando aún no se ha hecho efectiva la respuesta inmune humoral.
En la fase de reposo actúan una serie de enzimas naturales que escinden lentamente a C3 en un fragmento pequeño C3a y otro mayor C3b inactivo (Figura 4).
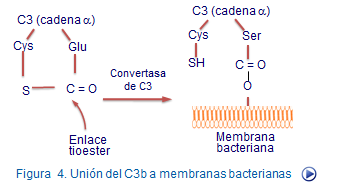
Por el contrario en la vía de amplificación, cambia el destino de C3b, pues en vez de entrar en una vía de catabolismo forma un enlace covalente con la superficie del germen que amplifica la vía alternativa (Figura 5). Este hecho y la intervención del factor B, D y que ciertos complejos actúan de convertasa del C3b hacen que el germen termine siendo opsonizado por moléculas de C3b, es decir, "marcado" para ser reconocido y fagocitado por células macrófago. En paralelo a la liberación de C3b se producen fragmentos de C3a de gran importancia funcional como veremos después.
Vía clásica
Esta vía se inicia en la superficie de células o bacterias cuando a ellas se unen anticuerpos formados frente a las mismas. En este caso la fracción C1, se une a los anticuerpos cuando se encuentra unidos a Ags y son del tipo IgM oIgG de las clases IgG1, IgG2 o IgG3.

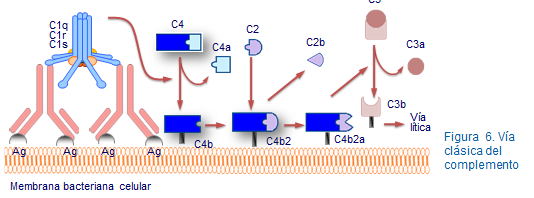
El factor C1 está compuesto por tres subunidades proteicas, C1q, C1r y C1s con funciones diferenciadas (figura 6). Lasubunidad C1q es la encargada de fijarse al extremo Fc del anticuerpo (Figura 7). C1q activa a la otra molécula C1r. Dos moléculas de C1r aracan a dos moléculas de C1s, activándolas y convirtiéndolas en una enzima del tipo serin-proteasa cuyo substrato son los factores C2 y C4.

Después tanto el C4 como el C2 se fraccionan y sus fragmentos terminan formando el C4b2b. Este complejo actúa sobre el factor C3 que se transforma por proteólisis en un fragmento C3a y otro C3b el cual se une a la membrana celular. El germen se ve progresivamente rodeando por miles de fragmentos C3b para el cual tienen receptores los macrófagos. Estos erminan fagocitando y destruyendo en lo que constituye el mecanismo de muerte más importante del complemento (Figura 8).
Convertasa de la C5
Posteriormente en un ambiente en el que se generan grandes cantidades de C3b, estos fragmentos se acoplan con el ya existente en la membrana, C4b2a, para dar el complejo C4b2a3b o convertasa de C5 de la vía clásica.
Vía de las lectinas
Esta vía se inicia cuando la proteína fijadora de manosa (MBP, mannose-binding protein) reconoce restos de manosa en los polisacáridos de membrana de una gran variedad de gérmenes (bacterias, hongos, protozoos y virus). Por tanto esta vía puede activarse en ausencia de anticuerpos y por tanto se puede poner en marcha incluso en individuos que no han sido previamente inmunizados.
La MBP se encuentra en suero y adquiere actividad enzimática cuando uno de sus extremos reconoce a la manosa sobre la superficie de gérmenes activando y escindiendo al factor C2 y al factor C4 de forma similar a como lo hace C1. Además la MBP, se puede comportar como un factor opsonizante para los gérmenes, facilitando así su fagocitosis y destrucción por parte de células del sistema fagocítico mononuclear (Figura 3).

En esta vía confluyen las rutas clásicas, de la lectina y alternativa. Se caracteriza por formar el complejo final con capacidad citolítica propia de la cascada del complemento (Figura 9).
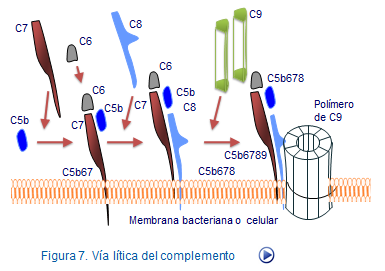
Se inicia con la escisión de C5 en dos componentes, C5b y C5a por acción de los productos finales de la vía clásica y de la lectina. Como consecuencia, miles de fragmentos de C5b se unen a la membrana, y cada uno de ellos capta desde la fase fluida circundante los fragmentos C6 y C7, que ya adquieren actividad quimiotáxica y de fijación a membranas.
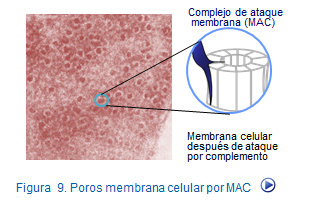
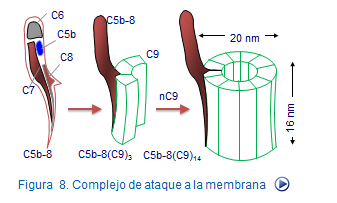
Si al complejo C5b67 se une la fracción C8, el complejoC5b678 adquiere capacidad citolítica gracias a que C8 modifica su configuración espacial para ofrecer zonas hidrofóbicas que facilitan su inserción en la membrana. Este complejo adquiere capacidad para interactuar con el factor C9 formando el complejo C5b6789. Este complejo recibe el nombre de complejo de ataque a la membrana (MAC) (Figura 10).

Receptores para factores del complemento
Muchas de las funciones del complemento se llevan a cabo tras la unión de fragmentos de algunos factores del complemento a receptores presentes en la superficie de algunas células (Tabla 1).

El complemento posee la función esencial de reconocer y eliminar microorganismos, para lo cual actúan como parte de la respuesta inmune innata o potenciando la acción de los anticuerpos en la respuesta adaptativa humoral. Destacan las funciones de:
1. Acción citolítica del complemento. La lisis directa de un gran número de bacterias, conocida como citotoxicidad dependiente del complemento, se desarrolla por los cambios electrolíticos y osmóticos que producen los miles de poros formados por el complejo de ataque a la membrana (MAC).
2. 2. Acción facilitadora de la fagocitosis.Algunos factores tras su activación, se asientan de forma estable sobre la superficie de gérmenes y células quedando así opsonizado un té rmino que etimológicamente significa “marcado para ser comido”.
3. Acción anafilotóxica del complemento. En algunos de los pasos de las vías del complemento se liberan pequeños fragmentos, como C3a, C4a y C5a, que poseen funciones inductoras de inflamación por su acción estimulante de células cebadas. De esta manera, cuando se liberan provoca una vasodilatación y por consiguiente un aumento de la permeabilidad del vaso, lo que facilita la llegada de más fagocitos y factores del complemento desde la sangre (Tabla 13.2).
4. 4. Acción quimiotáctica del complemento.Ciertos factores, como el C5a, liberados en las reacciones del complemento, poseen la capacidad de atraer células al foco inflamatorio (quimiotaxis).
5. Aclaramiento de inmunocomplejos. Los eritrocitos, mediante su receptor CR1 y a través del factor C3b unido a inmunocomplejos circulantes, hacen que éstos sean eliminados desapareciendo su peligrosidad para el organismo. Este proceso ocurre en el hígado o bazo. Así, a su paso por el hígado o el bazo, los macrófagos de estos órganos, mediante sus receptores CR1, CR3 o CR4, unen los inmunocomplejos a través de C3b (o mediante receptores para Fc a través de IgG) y los fagocitan quedando libres los eritrocitos para captar nuevos inmunocomplejos. Como el hematíe es la partícula celular más abundante de la sangre es fácil entender la eficiencia de este mecanismo. (Figura 13.13)
 6. Estimulación de la respuesta inmune humoral. Los linfocitos B poseen un receptor (CR2) para varios subproductos del
6. Estimulación de la respuesta inmune humoral. Los linfocitos B poseen un receptor (CR2) para varios subproductos del 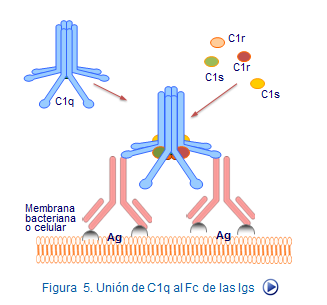

Bibliografía
1. Carroll MC. The complement system in regulation of adaptive immunity. Nat Immunol. 2004, 5: 981-6.
2. Carroll MC. The complement system in B cell regulation. Mol Immunol. 2004, 41: 141-6.
3. Fujita T, Endo Y, Nonaka M. Primitive complement system recognition and activation. Mol Immunol. 2004,4 1: 103-11.
4. Fremeaux-Bacchi V, Dragon-Durey MA, Blouin J, Mouthon L, Fridman WH. Investigation of the complement system in clinical practice, Ann Med Interne (Paris). 2003, 154: 529-40.
5. Nonaka M, Yoshizaki F. Evolution of the complement system. Mol Immunol. 2004, 40: 897-902.