05. RECEPTOR DE LINFOCITOS T
Los linfocitos T reconocen a los antígenos, presentados en forma de péptidos por las moléculas HLA, a través delreceptor de las células T (TCR).. Como consecuencia se inicia el proceso de activación de estos linfocitos.
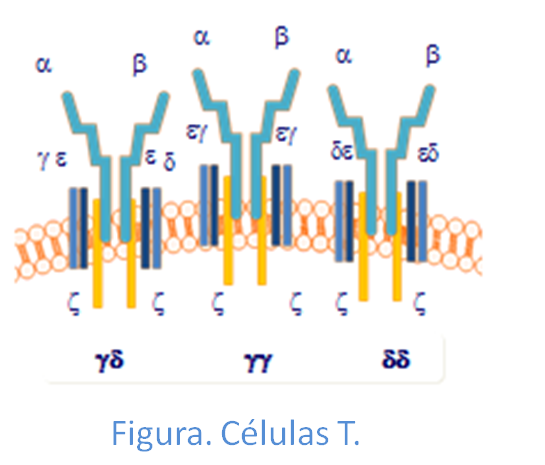
 EL TCR está formado por la asociación de dos cadenas polipeptídicas α y β (TCR αβ) o bien, a veces por las cadenas γ y δ (TCRγδ), aunque de forma muy poco frecuente. Cada uno de los receptores tiene una porción específica (polimórfica) en la que se da la variación clonotípica que permite el reconocimiento de los diferentes antígenos. Estos receptores presentan especificidades distintas y se encuentran a su vez en grupos de linfocitos distintos (clones), por ello a este receptor se conoce como receptor clonotípico.
EL TCR está formado por la asociación de dos cadenas polipeptídicas α y β (TCR αβ) o bien, a veces por las cadenas γ y δ (TCRγδ), aunque de forma muy poco frecuente. Cada uno de los receptores tiene una porción específica (polimórfica) en la que se da la variación clonotípica que permite el reconocimiento de los diferentes antígenos. Estos receptores presentan especificidades distintas y se encuentran a su vez en grupos de linfocitos distintos (clones), por ello a este receptor se conoce como receptor clonotípico.
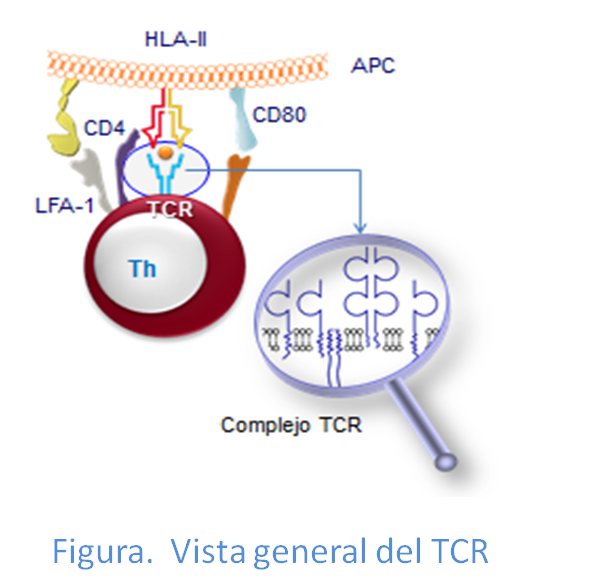
A su vez el TCR se encuentra unido a un grupo de moléculas de membrana, moléculas CD3, formando así el complejo TCR/CD3 (Figura: Sinapsis APC/Th). Las moléculas CD3, junto con otra molécula dimérica conocida como cadena ζ, tienen la función de transmitir las señales recibidas del antígeno al interior celular. Finalmente, se desencadena una cascada de reacciones en el citoplasma de la célula T, iniciándose así, el proceso de activación de los linfocitos T.
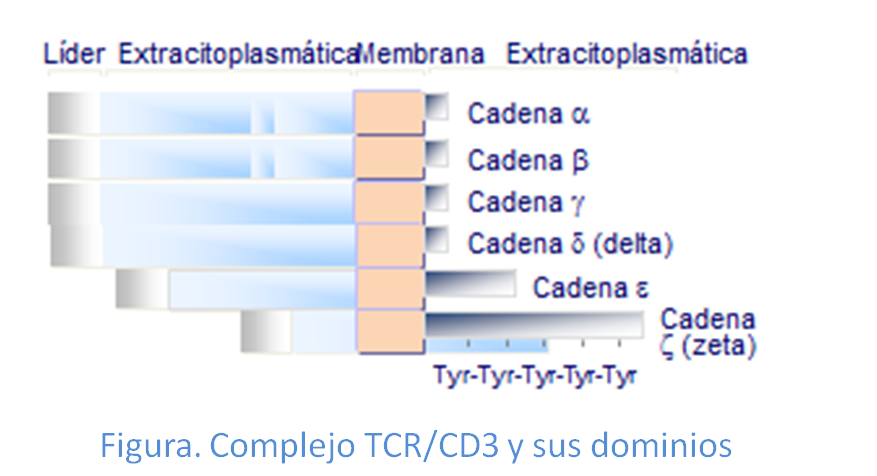
Estructura complejo TCR/CD3
Las cadenas α y β del TCR están unidas entre sí por puentes disulfuro y poseen, cada una de ellas, al igual que las Igs, una parte constante y otra variable, que permite el reconocimiento de más de 108péptidos diferentes. Ambas cadenas están glicosiladas y se componen de una parteextracelular, otra transmembranay una pequeña parte intracelular.
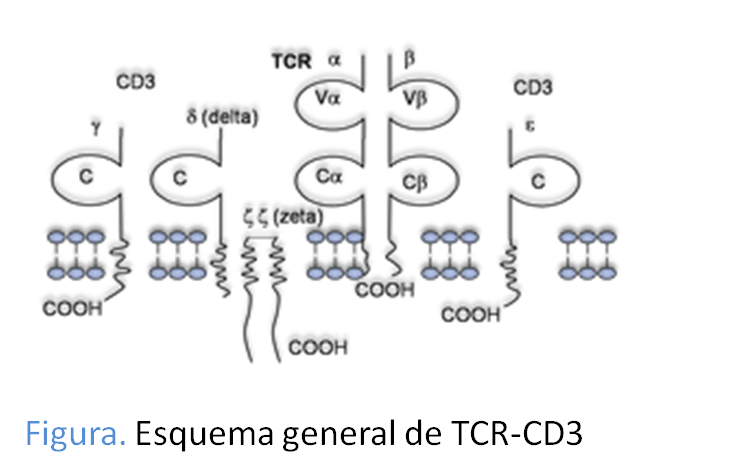
El complejo CD3, corresponde a la porción invariable del complejo, está formado por al menos 3 monómeros, denominados γ, δ y ε y un dímero de cadenas ζ. Las cadenas γ, δ y ε son glicoproteínas constituidas por tres partes: extracelular, transmembrana y citoplasmática. Sinembargo la subunidad ζ tiene una estructura algo distinta, ya que su dominio intracelular es de mucho mayor tamaño que el extracelular, lo que le confiere mayor capacidad de intervenir en la transmisión de señales (Figura: Dominios TCR/CD3).
En los dominios citoplasmáticos de las cadenas que forman el CD3 (γ, δ, ε y en la cadena ζ) existen unas regiones denominadas motivos de activación basados en tirosina (ITAM). Estas moléculas se caracterizan por ser ricas en tirosinas y susceptibles de serfosforiladas en el
proceso de transducción de señales de activación intracelular. Cada una de las cadenas γ, δ, ε posee uno de estos motivos ITAM, mientras que la cadena ζ posee tres; ya que su dominio intracelular es mayor (Figura: Dominios ITAM)
Las cadenas del TCR y CD3 se sintetizan en los polirribosomas y el ensamblaje de dichas cadenas se produce mientras éstas se encuentran en el retículo endoplásmico CD3. Las moléculas formadas abandonan el retículo endoplásmico a través del Aparato de Golgi, a la superficie celular. Al igual que ocurre en la síntesis de Igs, los genes que codifican las cadenas α y β del TCR están formadas a partir de la recombinación de segmentos génicos que hace que se genere una enorme número de diferentes receptores. Así, los genes de las cadena TCR α y β codifican la parte variable mientras que la parte constante está codificada por un solo segmento para la cadena α y por dos para la cadena β (Figura: Genética TCR). En contraposición con el receptor TCRαβ, el receptor TCRγδ posee una variabilidad estructural y génica de sus cadenas muy limitada.
 En consecuencia la diversidad del TCRαβ se debe a la combinación aleatoria de los múltiples segmentos de genes de las cadenas α y β; a las uniones imprecisas entre los distintos segmentos genéticos en el proceso de recombinación de los mismos y a las múltiples mutaciones que aparecen de los segmentos de genes intervinientes en la formación de las cadenas de dicho receptor T.
En consecuencia la diversidad del TCRαβ se debe a la combinación aleatoria de los múltiples segmentos de genes de las cadenas α y β; a las uniones imprecisas entre los distintos segmentos genéticos en el proceso de recombinación de los mismos y a las múltiples mutaciones que aparecen de los segmentos de genes intervinientes en la formación de las cadenas de dicho receptor T.
Función del TCR/CD3
Una vez producido por los TCRs el reconocimiento de los péptidos unidos a moléculas HLA-I o HLA- II se produce la internalización de las señales a través de las moléculas de las CD3. Ello 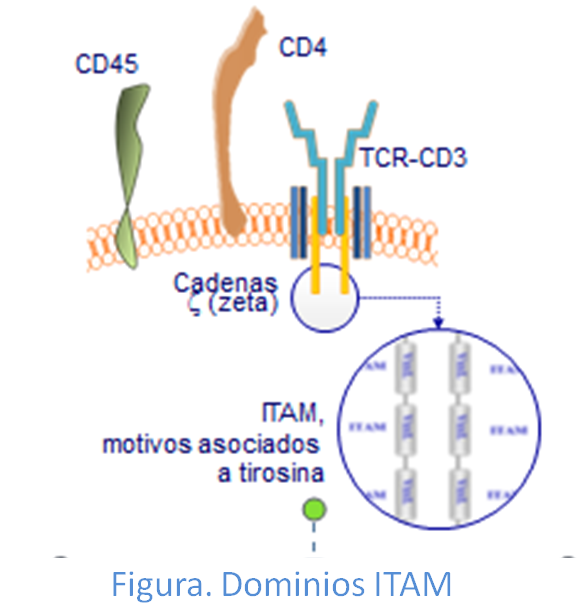 induce a una cascada de señales intracelulares y la activación de diferentes factores de transcripción celular que determinan la producción de citocinas o factores citotóxicos, según se trate de linfocitos Th o Tc respectivamente
induce a una cascada de señales intracelulares y la activación de diferentes factores de transcripción celular que determinan la producción de citocinas o factores citotóxicos, según se trate de linfocitos Th o Tc respectivamente
Un caso especial de activación de linfocitos T se produce por sustancias presentes en bacterias, como ciertos estafilococos, que se denominansuperantígenos. Se caracterizan por activar de manera masiva a los linfocitos. A diferencia del reconocimiento de péptidos unidos a las moléculas de HLA convencionales que se hace de manera específica por la regiones variables del TCR, en el caso de los superantígenos no ocurre así. Cada superantígeno tiene dos sitios de unión, uno para la molécula HLA clase II, fuera de la hendidura de reconocimiento peptídico, y otro para el TCR, situado en la región Vb fuera del sitio clásico de 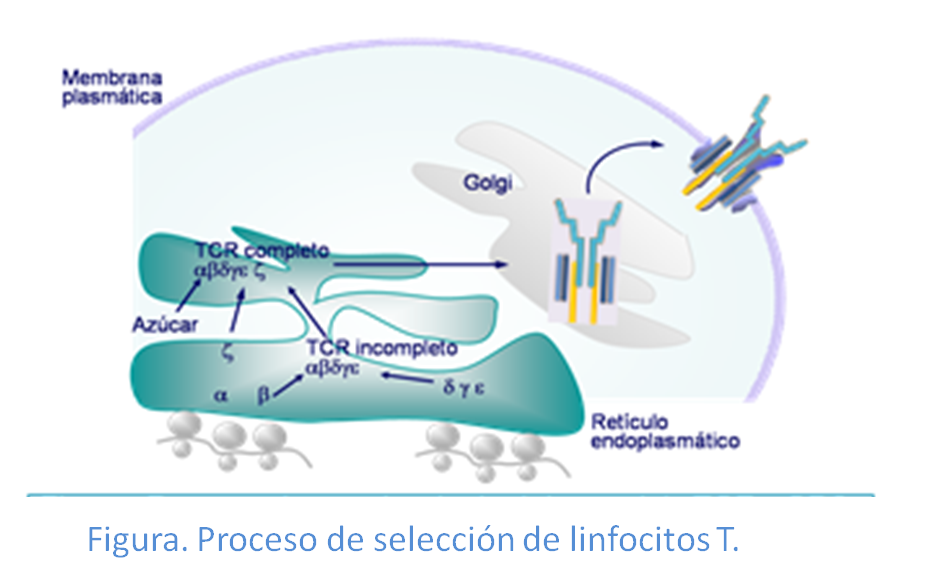 unión al complejo HLA-antígeno. Esta característica hace posible que un mismo superantígeno pueda interaccionar con TCRs de múltiples células T, con lo que se produce una expansión masiva de las células T activadas implicadas en dicho reconocimiento y la subsiguiente producción de una oleda de las citocinas la IL-1, IL-2 y TNF-alfa (Figura: Superantígeno)
unión al complejo HLA-antígeno. Esta característica hace posible que un mismo superantígeno pueda interaccionar con TCRs de múltiples células T, con lo que se produce una expansión masiva de las células T activadas implicadas en dicho reconocimiento y la subsiguiente producción de una oleda de las citocinas la IL-1, IL-2 y TNF-alfa (Figura: Superantígeno)
Esto es lo que ocurre en muchos casos tras una infección por estafilococos, debido a que las enterotoxinas estafilocócicas que producen y que sabemos actúan como superantígenos, 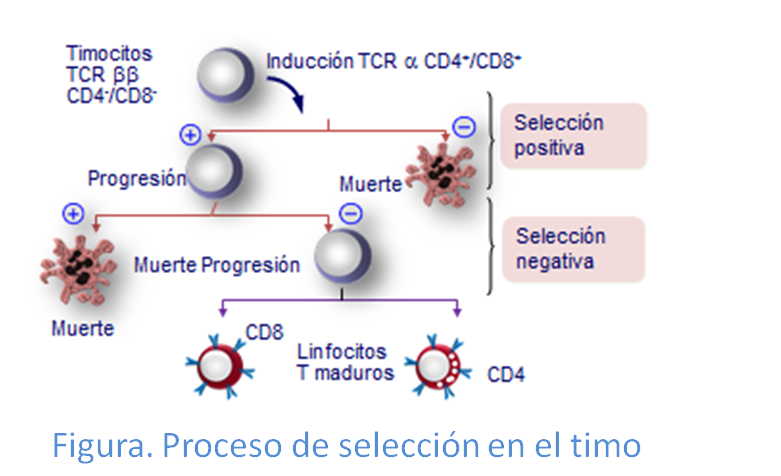 uniéndose simultáneamente a moléculas de histocompatibilidad clase II de las células presentadoras de antígenos y a los TCRs de los linfocitos T. Como consecuencia, se produce una activación masiva que puede afectar entre el 5 y el 20 % de los linfocitos Th y a la superproducción de las citocinas pro- inflamatorias. Todo ello puede dar lugar a grandes cambios en el organismo, como vasodilatación periférica, que incluso pueden derivar en la muerte del paciente si no se trata a tiempo. Es lo que se llama Shock séptico, enfermedad que en términos generales arroja el mayor grado de mortalidad en las unidades de cuidados intensivos (UCIS) hospitalarias).
uniéndose simultáneamente a moléculas de histocompatibilidad clase II de las células presentadoras de antígenos y a los TCRs de los linfocitos T. Como consecuencia, se produce una activación masiva que puede afectar entre el 5 y el 20 % de los linfocitos Th y a la superproducción de las citocinas pro- inflamatorias. Todo ello puede dar lugar a grandes cambios en el organismo, como vasodilatación periférica, que incluso pueden derivar en la muerte del paciente si no se trata a tiempo. Es lo que se llama Shock séptico, enfermedad que en términos generales arroja el mayor grado de mortalidad en las unidades de cuidados intensivos (UCIS) hospitalarias).
 TCR en la selección tímica
TCR en la selección tímica
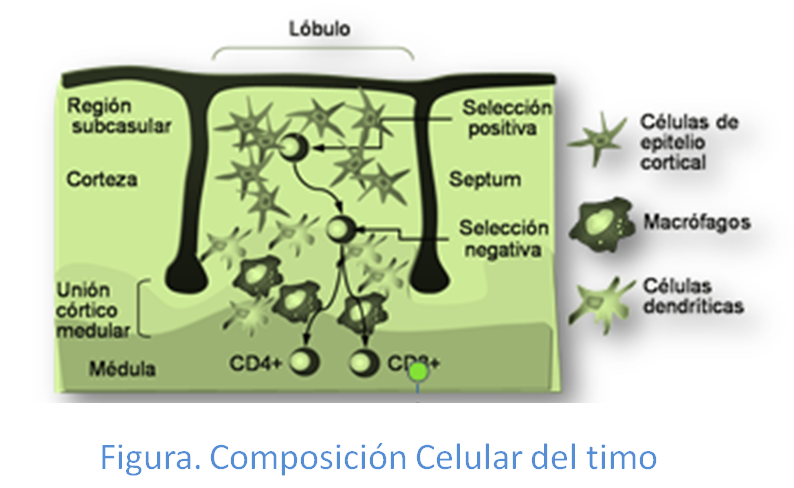
El TCR, además de en el proceso de reconocimiento de antígenos, participa también controlando el proceso de maduración de los precursores de los linfocitos T,timociotos, en el timo en los dos procesos en los que se lleva a cabo, la selección positiva y selección negativa (Figura: Selección tímica).
En el proceso de selección positiva sobreviven aquellos timocitos que poseen la capacidad de reconocer de manera débil mediante sus receptores TCR a las moléculas de histocompatibilidad 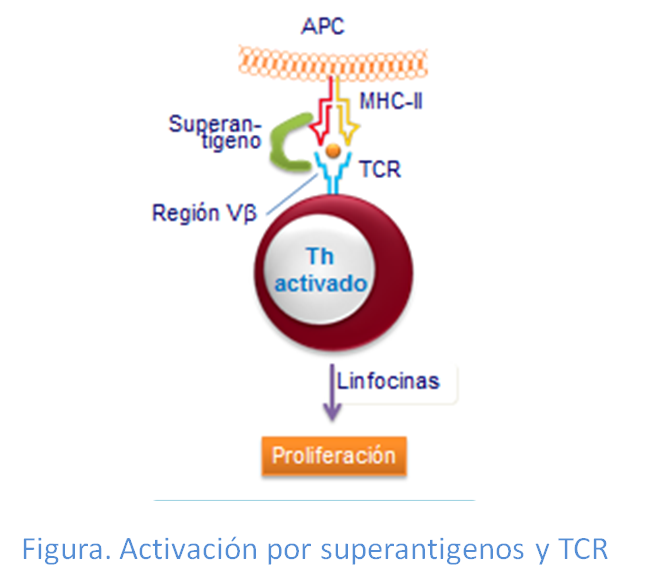 presentes en células epiteliales del timo. Los linfocitos al entrar en el córtex tímico, en contacto con estas células epiteliales que expresan HLA-I y HLA-II, se genera una interacción HLA-TCR que produce modificaciones en el TCR del linfocito. Esto hace que el 90% de estos sean incapaces de reconocer las moléculas HLA propias y, en consecuencia mueran. El 10% restante, serán los timocitos, que como hemos dicho anteriormente, reconocen las moléculas HLA con una afinidad suficiente que hace que evite la apoptosis.. Esto asegura que en el futuro las células maduras reconocerán los antígenos en el contexto de las propias moléculas de histocompatibilidad de cada una de las personas. Por el contrario mueren los timocitos que no llegaron a realizar esta unión con HLA y antígenos a través de uniones débiles.
presentes en células epiteliales del timo. Los linfocitos al entrar en el córtex tímico, en contacto con estas células epiteliales que expresan HLA-I y HLA-II, se genera una interacción HLA-TCR que produce modificaciones en el TCR del linfocito. Esto hace que el 90% de estos sean incapaces de reconocer las moléculas HLA propias y, en consecuencia mueran. El 10% restante, serán los timocitos, que como hemos dicho anteriormente, reconocen las moléculas HLA con una afinidad suficiente que hace que evite la apoptosis.. Esto asegura que en el futuro las células maduras reconocerán los antígenos en el contexto de las propias moléculas de histocompatibilidad de cada una de las personas. Por el contrario mueren los timocitos que no llegaron a realizar esta unión con HLA y antígenos a través de uniones débiles.
Por otra parte en la selección negativa mueren por apoptosis todo aquellos timocitos que 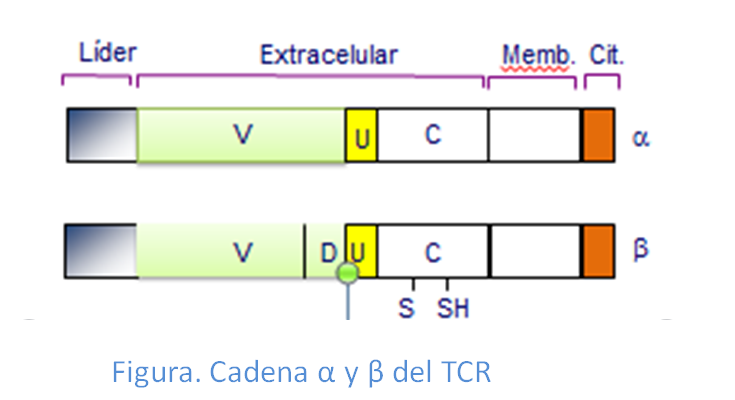 reconocen con gran avidez mediante su TCR a las moléculas de histocompatibilidad presentes en
reconocen con gran avidez mediante su TCR a las moléculas de histocompatibilidad presentes en
células dendríticas del timo unidas a los péptidos propios presentados por ellas. Este tipo de selección se caracteriza porque los linfocitos, que reconocen a los péptidos propios con fuerte afinidad, son eliminados; y aquellos que reconocen con afinidad débil, sobreviven. Al eliminar aquellos clonos celulares que reconocen las propias moléculas HLA más péptidos propios, pueden tener capacidad autorreactiva una vez 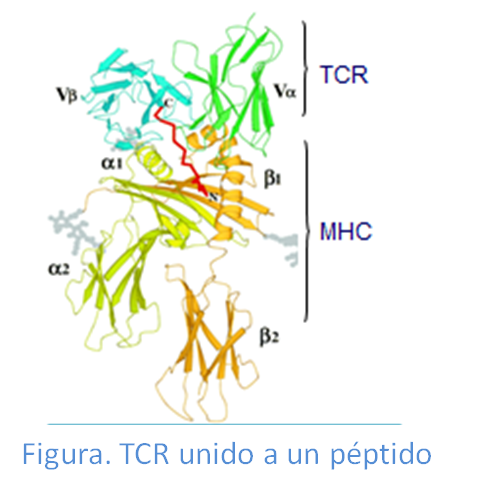 han llegado a formar linfocito T maduros. Precisamente, al eliminarse estas células se evita esto y la posibilidad de desarrollo de enfermedades autoinmunes en el futuro. Finalmente las células supervivientes (menos del 3% del total) dejan de expresar uno de los dos correceptores (CD4 o CD8), dando lugar a células CD4+CD8- TCRα-β o CD4-CD8+ TCRα-β maduras (Figura: Vías de selección).
han llegado a formar linfocito T maduros. Precisamente, al eliminarse estas células se evita esto y la posibilidad de desarrollo de enfermedades autoinmunes en el futuro. Finalmente las células supervivientes (menos del 3% del total) dejan de expresar uno de los dos correceptores (CD4 o CD8), dando lugar a células CD4+CD8- TCRα-β o CD4-CD8+ TCRα-β maduras (Figura: Vías de selección).
Referencias
1.Van der Merwe PA, Dushek O.; Mechanisms for T cell receptor triggering. Nat Rev Immunol. 2011;11(1):47.
2.Choudhuri K, van der Merwe PA.; Molecular mechanisms involved in T cell receptor triggering. Semin Immunol. 2007; 9(4):255-61.
3.Varma R. TCR triggering by the pMHC complex: valency, affinity, and dynamics. Sci Signal. 2008, 13;1(19):21