03. INMUNOGLOBULINAS
Las inmunoglobulinas son de gran importancia en la defensa del organismo ya que tienen la capacidad de identificar y neutralizar sustancias extrañas. De ahí que históricamente las inmunoglobulinas (Igs) se conociesen con el nombre de anticuerpos (ACs), por su función de anteponerse a lo extraño.
Existen cinco isotipos de inmunoglobulinas: IgM, IgA, IgG, IgD e IgE, cada una de ellas con ciertas características diferenciales, pero todas ellas con capacidad de unirse a antígenos de manera específica. En este capítulo analizaremos su estructura, su función y el control genético de su síntesis.
Estructura de las Inmunoglobulinas
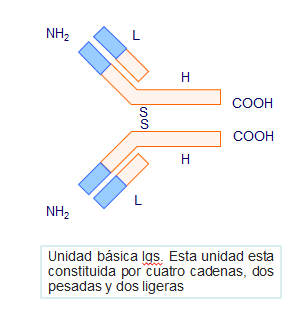
Las inmunoglobulinas están formadas por cuatro cadenas polipeptídicas. Dos son de mayor tamaño y se denominan cadenas pesadas, y dos, de menor tamaño y se denominan cadenas ligeras. Las cadenas ligeras y pesadas se agrupan de tal manera que existe una proximidad espacial entre los cuatro extremos amínicos por una parte, y los extremos carboxílicos por otra. Las inmunoglobulinas pueden ser fraccionadas mediante la utilización de enzimas (papaína, pepsina, etc.), obteniéndose diferentes tipos de fragmentos. Esto permitió no sólo conocer la estructura de estas moléculas sino también deducir la función de cada una de sus partes (Figura: Estructura unidad básica).
Cadenas ligeras
tipos de cadenas ligeras diferentes: tipo kappa (κ) y lambda(λ) que poseen unos 200 aminoácidos cada una y se unen a las pesadas por un puente disulfuro intercatenario (entre cadenas). En cada molécula de inmunoglobulina las dos cadenas ligeras que la forman son del mismo tipo, o bien κ o bien λ (Figura: Fragmentos Igs).
Cadenas pesadas
Están formadas por unos 400 aminoácidos y están unidas entre sí por puentes disulfuro intercatenarios, que pueden ser distintos en número dependiendo del tipo de inmunoglobulina. Esta zona, donde se encuentran los puentes intercatenarios, es muy flexible y constituye lo que se denomina zona bisagra, que es por donde se deforman estas moléculas cuando se unen al antígeno.
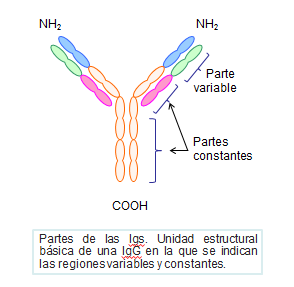
Parte variable y constante de las cadenas ligeras y pesadas
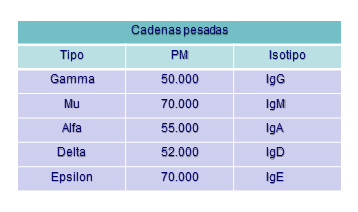
La parte constante de estas cadenas es diferente según la clase de inmunoglobulina que consideremos. Así, estas cadenas pueden ser de tipo: γ, α, μ, δ y ε, que definen a su vez las cinco clases de inmunoglobulinas: IgG, IgA, IgM, IgD e IgE respectivamente. (Figura: Cadenas Igs).
Características de las distintas clases de Inmunoglobulinas
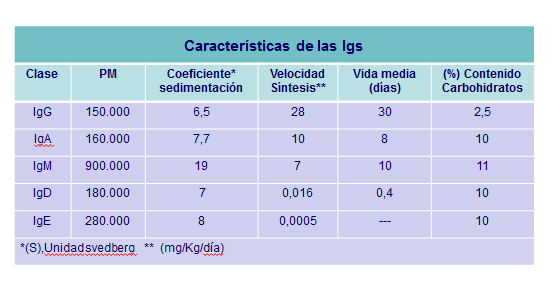
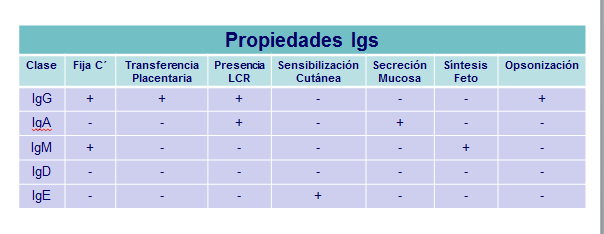
Las cadenas pesadas son las responsables de las propiedades biológicas, tales como la capacidad de unirse entre sí, fijar complemento, fijar la pieza de secreción y unirse a macrófagos, neutrófilos y células NK. Incluso entre moléculas de una misma clase existen diferencias en función de la subclase a la que pertenezcan.(Tabla: Características Igs).
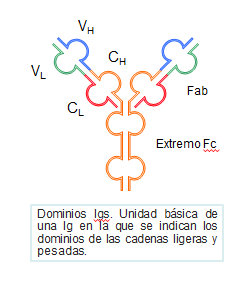
Dominios moleculares en las cadenas ligeras y pesadas
Tanto las cadenas pesadas como las ligeras poseen grupos de aminoácidos unidos por puentes disulfuro intracatenarios (entre elementos de una misma cadena), conocidos como dominios. La cadena L tiene dos dominios, uno corresponde a la región variable (VL) y otro a la constante (CL).
Regiones hipervariables
Las zonas variables, tanto de la cadena L como H, poseen a su vez unas regiones de mayor grado de variabilidad. Son tres pequeños segmentos muy variables, por lo que se les conoce como regiones hipervariables, cuya importancia radica en que conforman el centro activo de las Igs, que es por donde se produce el reconocimiento y unión al antígeno.
Cada una de estas regiones hipervariables se compone de 17 a 20 aminoácidos, de tal manera que pequeños cambios suponen una enorme fuente de variabilidad de posibilidades de unión al antígeno sin cambiar el resto de la molécula (Figura: IgG).
Moléculas adicionales a la estructura básica
En las inmunoglobulinas, además de las cuatro cadenas polipeptídicas básicas, existe un componente glucídico (que representa aproximadamente el 10% de la molécula), y ciertas inmunoglobulinas contienen una glicoproteína adicional conocida como cadena J.
Estructura espacial de las Inmunoglobulinas
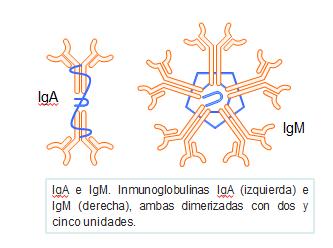
Las inmunoglobulinas pueden estar constituidas por unidades básicas simples, como es el caso de la IgG, IgD e IgE; en forma de dímeros (dos unidades básicas unidas), como es el caso de la IgA, o incluso formadas por hasta cinco estructuras básicas unidas por sus extremos Fc como es el caso de la IgM (Figura: Pentámero IgM).
Las cadenas pesadas y ligeras están plegadas sobre sí mismas, en forma de hoja plegada β, gracias a sus dominios (Figura: Dominios Igs).
Se sabe que no todas las inmunoglobulinas de una misma clase tienen idéntica estructura, sino que dentro de cada isotipo se pueden establecer subtipos considerando la secuencia de aminoácidos de la región constante de las cadenas H y el diferente número y situación de los puentes disulfuro intercatenarios establecidos entre las cadenas pesadas, es decir, que dentro de una misma inmunoglobulina, se pueden encontrar diferentes tipos atendiendo a la secuencia de aminoácidos de la región constante de cadenas pesadas y a la situación y número de los puentes disulfuro que se establecen entre estas cadenas pesadas. Así, la IgG humana se divide en cuatro subclases (IgG1, IgG2, IgG3 e IgG4) y la IgA (IgA1 e IgA2).
Alotipos de Igs
Si se inmuniza un animal con inmunoglobulinas de otro animal de la misma especie, se pueden obtener antisueros que van dirigidos contra ciertas regiones constantes de las inmunoglobulinas que son distintas entre ambos animales (Figura: Anti alotipo).Esto se debe a la presencia de alotipos, definidos por pequeños cambios en las zonas constantes de las cadenas pesadas y ligeras que hacen que las Igs de unos individuos a otros de la misma especie sean diferentes. En humanos se han descrito tres tipos de alotipos.
Se entiende por idiotipo el conjunto de determinantes antigénicos situados en las regiones variables de las cadenas ligeras y pesadas de un determinado anticuerpo. Esta zona es precisamente por donde se produce su acoplamiento al antígeno que indujo su formación. Es pues una zona de estructura complementaria al antígeno y que a su vez puede actuar, cuando se van formando como antígeno, induciendo nuevos anticuerpos en el individuo (Figura: Idiotipos).
Los idiotipos, según la Teoría de Jenner, parecen tener importancia en la regulación del sistema inmune. Frente a los idiotipos de las Igs más recientemente secretadas en un individuo, se formarían anticuerpos por el mismo individuo que al unirse a los mismos formarían una red de anticuerpos. Todo ello en cascada, de tal manera que la acción final contribuiría a la regulación del proceso de síntesis de nuevos anticuerpos.
Distribución de las Inmunoglobulinas
Las inmunoglobulinas se encuentran distribuidas por todo el organismo. Las cantidades relativas de cada una de las clases de inmunoglobulinas en los diferentes compartimentos son muy diferentes. En el torrente sanguíneo predomina la IgG mientras que en las secreciones (saliva, lágrimas, secreción bronquial, líquido cefalorraquídeo y mucosas) predomina la IgA. Los niveles de inmunoglobulinas séricas fluctúan ampliamente en función del estado nutricional,edad, enfermedades, infecciones y otras muchas situaciones.
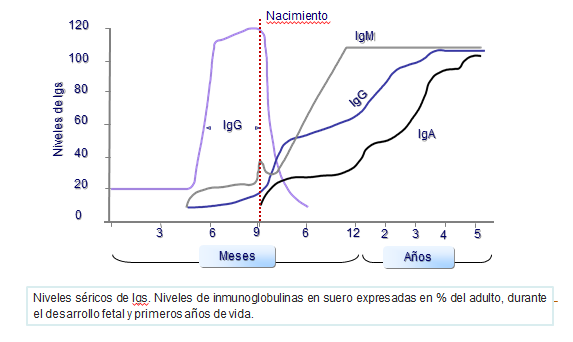
Durante la lactancia, descienden los niveles de IgG, ya que ésta procedía de la madre y el niño todavía carece de la capacidad de sintetizarla. También en la edad fetal se sintetizan pequeñas cantidades de IgM (Figura: Niveles séricos).
Superfamilia de las Inmunoglobulinas
Existe un gran número de moléculas que poseen una estructura organizada en dominios, equivalente a la que poseen las Igs. A estas sustancias se les conoce como miembros de la familia de las inmunoglobulinas. Entre las diferentes moléculas de esta superfamilia, se encuentran, además de las propias inmunoglobulinas.
- Muchos de los componentes moleculares que conforman los receptores de los linfocitos T y B.
- Las moléculas de histocompatibilidad.
- Muchas de las moléculas de adhesión celular.
- Ciertas moléculas involucradas en la circulación y tráfico de los leucocitos.
Función de las Inmunoglobulinas
La función esencial de las inmunoglobulinas es la de unirse a antígenos. De esta manera las inmunoglobulinas a) pueden colaborar en la destrucción de los mismos cuando las inmunoglobulinas se encuentran de forma soluble o b) puede actuar como receptoras de señales antigénicas cuando se encuentran formando parte de los receptores de los linfocitos B.
Unión antígeno-anticuerpo
Epítopos y paratopos
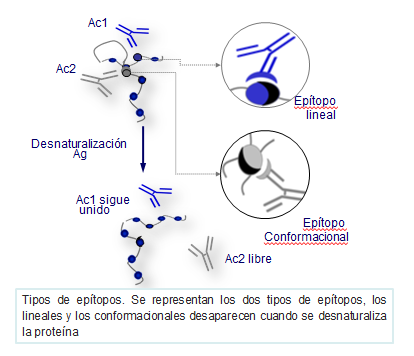
Los epítopos de un antígeno pueden estar formados por aminoácidos consecutivos de la proteína (epítopos lineales) o por zonas de confluencia (epítopos conformacionales) de varias cadenas (Figura: Tipos de epítopos).
Las inmunoglobulinas se unen a los epítopos de los antígenos por sus sitios activos, constituidos como se ha indicado anteriormente, por los segmentos variables de las cadenas pesadas y ligeras, donde intervienen principalmente las regiones hipervariables. Esta zona de unión de una inmunoglobulina al epítopo de un antígeno se conoce con el nombre de paratopo.
Fuerzas de unión Ag-Ac
La unión ag-ac es la consecuencia de múltiples interacciones entre unos y otros, de tal manera que la fuerza total de la unión puede ser muy elevada. Para que las interacciones mencionadas lleguen a ser efectivas, los grupos entre los que se establece deben estar situados a distancias muy cortas, y para que ésto sea posible y se puedan producir un gran número de interacciones, el epítopo y el paratopo deben encajar perfectamente, dependiendo de ello la “fuerza” de la interacción que conocemos con el nombre de afinidad.
Afinidad de la unión Ag-Ac
La afinidad en la interacción ag-ac es de gran importancia, ya que de ella depende la utilidad diagnóstica y de investigación de un anticuerpo y su importancia fisiopatológica. Para cuantificar la afinidad de una interacción, debemos de entender primero una serie de conceptos de los que nos ocuparemos a continuación. Al tratarse de uniones no covalentes, la unión Ag/Ac será reversible de modo que, cuando el antígeno y el anticuerpo se mezclan en solución, se estarán formando y disociando complejos constantemente de acuerdo con la siguiente ecuación:
Cuanto mayor sea la velocidad de asociación y menor la de disociación mayor será la afinidad de la interacción de esa pareja Ag/Ac. Otra forma complementaria y más directa de cuantificar la afinidad de la interacción Ag/Ac, es hacerlo una vez que se ha alcanzado el equilibrio y utilizando concentraciones bajas de anticuerpos. En estas condiciones la concentración de antígeno que permite que la mitad de los anticuerpos estén unidos a ellos y la otra mitad libre, medida en molaridad, se denomina constante de disociación (KD) y es una medida directa de la afinidad de la interacción.
Cuanto menor sea la KD mayor será la afinidad puesto que indica que es necesaria una menor concentración de antígeno para que la mitad de los anticuerpos estén ocupados. La inversa de la KD es la constante de asociación (KA) cuyo valor es directamente proporcional a la afinidad de la interacción.
Para determinar experimentalmente estas constantes tendremos que conocer las concentraciones de antígeno libre y unido, para lo cual existen varios métodos entre los que destacan análisis mediante diálisis de equilibrio (Figura: Moléculas difusibles).
Esta técnica se basa en la utilización de una membrana semipermeable de un poro tal, que permita el paso de un antígeno suficientemente pequeño (un hapteno) pero no del anticuerpo. A concentraciones bajas de antígeno, la concentración de anticuerpo libre irá bajando rápidamente hasta que se alcance el equilibrio, puesto que todo el antígeno que entre a través de la membrana semipermeable quedará retenido por el anticuerpo.
Realizando el experimento anterior con varias concentraciones de antígeno, podremos encontrar aquella en la que la mitad del anticuerpo se encuentra unido al antígeno que, como hemos dicho corresponde a la KD. La afinidad que hayamos calculado corresponderá exclusivamente a la de la interacción de esa pareja Ag/Ac. Un determinado anticuerpo podrá unirse a más de un antígeno con afinidades distintas en cada caso.
Avidez de la unión Ag-Ac
Como apuntábamos anteriormente, el fenómeno de la unión Ag/Ac es en realidad mucho más complejo, pues cada uno de los antígenos poseen varios epítopos distintos, por lo que podrán unir más de un anticuerpo. Cada molécula de anticuerpo, por su parte, podrá unir al menos dos moléculas de antígeno, una por cada Fab y en el caso de la IgM hasta diez moléculas, ya que se ensamblan en unidades funcionales constituidas por cinco moléculas de anticuerpos.
Finalmente en un antígeno, un determinado epítopo puede estar representado varias veces siendo capaz de unir varias moléculas del mismo anticuerpo. La fuerza total de la interacción que considera todas las interacciones epítopo/paratopo que tienen lugar entre antígenos y anticuerpos multivalentes (con varios sitios de unión), se denomina avidez y es mucho mayor que la suma de las afinidades, puesto que las distintas interacciones se estabilizan entre ellas.
Estas interacciones multivalentes poseen una gran importancia fisiopatológica ya que cuando se encuentran Ag y Ac en solución, como es el caso del plasma o tejidos, se forman agregados inmunocomplejos constituidos por muchas moléculas. A concentraciones equivalentes de Ag y Ac estos inmunocomplejos serán de gran tamaño y podrán quedar atrapados en los tejidos, iniciando una respuesta inflamatoria y dando lugar a las llamadas enfermedades por depósito de inmunocomplejos.
Propiedades biológicas de las Inmunoglobulinas
Tras la unión del antígeno y la inmunoglobulina, ésta puede anular la acción del antígeno por neutralización, precipitación o aglutinación. Así, si la Ig es específica para una toxina bacteriana, cuando se produce la unión Ag-Ig (toxina-antitoxina) quedan neutralizados los efectos tóxicos de la toxina. De ahí que clásicamente cuando no se conocía la estructura, se le denominase antitoxinas, precipitinas o aglutininas en función de la reacción que se detectaba en cada caso.
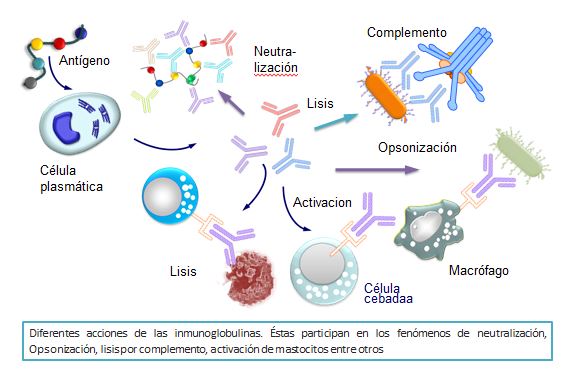
Estos fenómenos no son suficientes por sí solos para la destrucción y total eliminación de los antígenos. Para ello, además de las inmunoglobulinas se requiere de la colaboración de otros muchos elementos, tales como el sistema del complemento, los macrófagos, los polimorfonucleares o las células NK. Podemos decir que las inmunoglobulinas, al detectar los antígenos y producirse la subsiguiente unión a ellos, actúan como transductores de la información de la presencia de los mismos que serían destruidos por el complemento, los macrófagos, los polimorfonucleares o las células NK.
Opsonización
La unión de un antígeno a la inmunoglobulina produce una serie de cambios alostéricos en su extremo Fc que hacen adquieran la propiedad de unirse a receptores que se encuentran en la membrana de macrófagos y polimorfonucleares. A este fenómeno se le denomina opsonización. Al producirse esta unión, los macrófagos se activan, iniciándose el fenómeno de fagocitosis y subsiguiente destrucción de los complejos antígeno-anticuerpo por los procesos líticos intracelulares, propios de la acción de los enzimas contenidos en los lisosomas de estas células (Figura: Acciones de las Igs)
Estos receptores pueden ser de distinta naturaleza, conociéndose en la actualidad tres: FcgRI (CD64), FcgRII (CD32) y FcgRIII (CD16). Además de en los macrófagos estos receptores se encuentran en otras células como plaquetas, linfocitos B y NK.
Cuando se produce la unión a células NK, éstas se activan y provocan la destrucción de las células portadoras del antígeno por un mecanismo conocido como citotoxicidad celular dependiente de anticuerpos (ADCC). Algunos de estos receptores se encuentran en los mastocitos y basófilos, en cuyo caso a ellos se puede unir la IgE que los activa produciendo su degranulación con liberación de histamina y otras sustancias vasoactivas que darán lugar a procesos de hipersensibilidad que pueden ser graves.
Lisis por complemento
Cuando la inmunoglobulina que se une a un antígeno es IgM o IgG, en sus extremos Fc se producen ciertos cambios alostéricos gracias a los cuales éstas adquieren la propiedad de fijar y activar uno de los componentes del complemento. Las fracciones activas del complemento poseen diferentes acciones de gran importancia en la defensa del organismo, una de las cuales es la lisis celular. Este fenómeno se conoce como citotoxicidad mediada por el complemento, será estudiada en el capítulo dedicado al complemento.
Inmunoglobulinas en la respuesta primaria y secundaria
La respuesta primaria, producida cuando el Ag toma contacto con el organismo por primera vez, y secundaria, producida cuando el mismo Ag vuelve a activar al sistema inmune, son cualitativa y cuantitativamente, diferentes. Este fenómeno, que se basa en la especificidad y memoria de la respuesta inmune, es de gran importancia para el individuo y también es el fundamento de las vacunas. Las diferencias esenciales son:
1. En la respuesta primaria los niveles máximos de inmunoglobulinas se alcanzan tras un largo período de latencia después del estímulo antigénico, mientras que en la respuesta secundaria se alcanza más rápidamente. Ello se debe a que cuando un antígeno activa por primera vez a los linfocitos B, éstos necesitan tiempo para diferenciarse en las células plasmáticas responsables de la síntesis de inmunoglobulinas, mientras que cuando se trata de la respuesta secundaria, gracias a la permanencia de las células memoria, se alcanza en menor tiempo el nivel de células plasmáticas.
2. La respuesta primaria predomina la IgM, mientras que en la secundaria predomina la IgG.
3. La respuesta primaria es de menor intensidad que la secundaria. Ello se debe al tipo de inmunoglobulina predominante y a la presencia de células memoria predominantemente en la respuesta secundaria.
4. La respuesta secundaria, al predominar en ella la IgG, de vida media más larga que la IgM, y además por el predominio antes indicado de células memoria, es más permanente y duradera en su acción que la primera.
En su conjunto podemos decir que el sistema inmune funciona de forma secuencial, enviándole información entre los diferentes compartimentos con objeto de aumentar la eficiencia entre ellos para eliminar los patógenos.
Propiedades individuales de las inmunoglobulinas
Aunque en los apartados anteriores se ha hecho mención a las propiedades y función de las inmunoglobulinas, a continuación estudiaremos brevemente y por separado las características funcionales más relevantes de cada una de ellas.
Inmunoglobulina G
Es la inmunoglobulina más abundante y representa más del 70 % de las Igs séricas totales. Las diferentes subclases se presentan en proporciones muy diferentes, así la IgG1 es la subclase más frecuente seguida de la IgG2. Esta Ig posee capacidad neutralizante, precipitante, de fijar complemento, de unirse a células NK y a macrófagos (opsonización) y es capaz de atravesar activamente las membranas biológicas, incluida la placenta materna.
La propiedad de atravesar activamente las membranas biológicas es de sumo interés, especialmente la de atravesar la placenta desde la madre al feto.
Como el feto sólo sintetiza pequeñas cantidades de inmunoglobulinas, adquiere de este modo la posibilidad de defensa, no solamente mientras se encuentra en el seno materno, sino después del nacimiento, durante la lactancia, período durante el cual todavía no sintetiza inmunoglobulinas en cantidades significativas.
Sin embargo, este paso de IgG desde la madre al feto no siempre es beneficioso para el feto. Cuando hay incompatibilidad del tipo Rh entre la madre y el feto, se puede desarrollar el síndrome de eritroblastosis fetal como consecuencia de la destrucción de glóbulos rojos fetales, pudiendo ocasionar nefastas consecuencias si no se trata a tiempo.
Inmunoglobulina M
Los anticuerpos del tipo IgM son los que más rápidamente se forman en respuesta a un estímulo antigénico (Respuesta primaria). Esta Ig se caracteriza también por poseer capacidad neutralizante, precipitante, aglutinante, fijar complemento, activar la respuesta inmune, sin embargo no atraviesa activamente las membranas biológicas. Esta última propiedad hace que esta inmunoglobulina ejerza su acción, normalmente en los espacios intravasculares. Representa del 5 al 10 % de las Igs séricas totales y junto a la IgD es la más encontrada en la superficie de los linfocitos B como inmunoglobulina de membrana.
Inmunoglobulina A
Esta inmunoglobulina posee capacidad neutralizante y precipitante, mientras que su capacidad de fijar complemento y de opsonización es muy débil. La propiedad más importante de la IgA es la de unirse por su extremo Fc a la pieza secretora, gracias a la cual puede encontrarse en mucosas y glándulas exocrinas. Esto hace que ejerza su acción más importante en la superficie de mucosas y líquidos biológicos (sobre todo IgA2), tales como el líquido cefalorraquídeo, secreción bronquial, lágrimas, saliva, etc.
Esto es importante porque así protegen precisamente los puntos más vulnerables del organismo, esto es, las puertas de entrada al mismo, como son ojos, boca, aparato digestivo, sistema respiratorio, vagina, etc. No olvidemos que, por ejemplo, si desplegamos la mucosa del aparato respiratorio, la superficie que cubriríamos sería de unos 300 m2, superficie que se encuentra en contacto directo con el exterior a través del aire que se respira. Se deduce de ello que, sin duda, deben ser importantes los mecanismos de defensa local, entre los cuales la IgA tiene un papel esencial. Esta inmunoglobulina se encuentra también en la leche materna.
Los niveles de todas las inmunoglobulinas, a excepción de la IgG en recién nacidos son muy bajos, siendo por tanto de gran significación el hecho de que la IgA se transfiera desde la madre al lactante a través de la lactancia. De ahí que tengamos que insistir en que los niños se amamanten en el mayor número posible directamente por las madres y no con leche de otros orígenes. La IgA recibida de la madre ejerce un importante papel de defensa a nivel de todo el aparato digestivo. En ello parece que influyen las especiales características de pH gástrico del lactante que es menos ácido que en el adulto y permite que la IgA no sea degradada en el estómago.
Inmunoglobulina D
La concentración de esta inmunoglobulina en suero es muy baja. Hasta fechas muy recientes no se ha conocido su función aunque según los datos existentes colabora de forma importante en la activación de linfocitos B al actuar como receptor en la superficie de los mismos.
Inmunoglobulina E
En muchos individuos alérgicos esta inmunoglobulina se presenta en grandes cantidades. El estímulo para su síntesis puede proceder de una gran variedad de antígenos, a los que en este caso se denominan alérgenos. Los alérgenos pueden penetrar en el organismo a través de la piel o de las mucosas respiratoria, ocular, del aparato digestivo, etc., así como por sustancias inyectables, como es el caso de la penicilina u otros medicamentos. La vida media de la IgE en sangre periférica es de varios días.
No tiene capacidad de atravesar la placenta, por lo tanto, las reacciones de hipersensibilidad inmediata no pueden transferirse de manera pasiva de la madre al feto. También la IgE se encuentra en otros líquidos biológicos así como unida a basófilos y células cebadas, gracias a la propiedad que tiene esta inmunoglobulina de unirse por su extremo Fc a receptores de superficie presentes en dichas células. Estas células se caracterizan por encontrarse en la piel y mucosas y por contener abundantes gránulos citoplasmáticos, ricos en sustancias vasoactivas que se liberan una vez se activan y son responsables de inflamaciones y alergias.
Genética de las Inmunoglobulinas
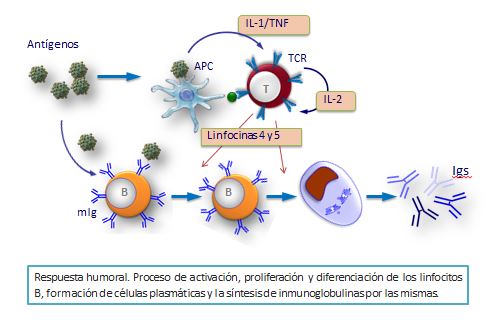
¿Cómo explicar que se sinteticen millones de anticuerpos distintos con el limitado material genético que posee cada individuo? Este dilema lo ha solucionado el organismo utilizando genes que poseen multitud de segmentos génicos internos, todos ellos presentes en las células más primitivas (embrionarias) de tipo B. En el proceso madurativo, estos segmentos de genes se recombinan de manera diferente para dar lugar a la formación de millones de linfocitos B diferentes y así se pueden sintetizar inmunoglobulinas diferentes.
Tipos de segmentos génicos
Los segmentos génicos que codifican la parte variable de las cadenas de Igs son V, D y J; mientras que otros segmentos codifican la parte constante.
Reordenamiento de los segmentos génicos de las Igs
A lo largo del proceso madurativo de los linfocitos B, se produce un reagrupamiento de segmentos de genes para la síntesis de las diferentes cadenas ligeras y pesadas de las Igs. A este fenómeno se denomina recombinación intracromosómica.
Efectivamente, a medida que se produce el proceso madurativo de los linfocitos B, ciertos segmentos V, D y J de forma aleatoria cambian de sitio en el cromosoma de tal manera que se colocan juntos. Posteriormente, este conjunto V/D/J se reagrupa con el segmento C correspondiente quedando constituido, en consecuencia, un gen con toda la información de la cadena. Cuando cada linfocito B ha madurado, posee ya reagrupados los genes correspondientes a sus cadenas ligeras y pesadas y sólo podrá producir un determinado tipo de anticuerpo.
Reordenamiento de genes de cadenas ligeras.
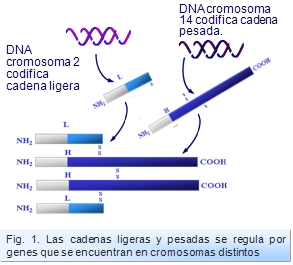 En la síntesis de cadenas ligeras participan los segmentos V, J y C (no hay genes D para la cadena ligera).
En la síntesis de cadenas ligeras participan los segmentos V, J y C (no hay genes D para la cadena ligera).
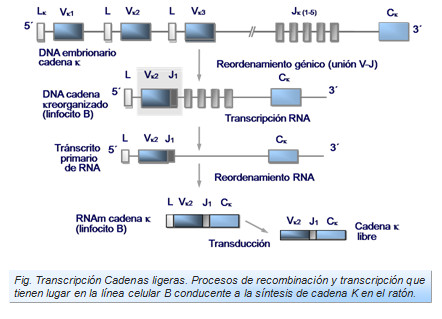
Así pues, en el proceso de recombinación de los genes de cadenas ligeras en cada uno de los linfocitos se acopla un segmento V con un segmento J. Estos a su vez se recombinan con el segmento correspondiente a la parte constante C. El proceso de transcripción se hace de tal manera que el RNA mensajero contiene información secuenciada V, J y C y no del resto se segmentos existentes en el DNA embrionario (Figura: Transcripción cadenas ligeras).
Reordenamiento de genes de cadenas pesadas
En este caso participan los segmentos V, D, J, y C. Primero se produce la recombinación entre un segmento D y un segmento J. En la segunda fase, este conjunto D/J se recombina con un segmento V. El complejo V/D/J se recombinan con cada uno de los segmentos que codifican las regiones constantes, según el isotipo de la inmunoglobulina a formar.
En el caso de la figura (Figura: Transcripción cadenas pesadas), la recombinación se ha producido entre VH3, D1, JH2, responsables de la parte variable de la cadena pesada. Estos se recombinan con la parte constante del segmento del gen Cg3, que originará la cadena pesada correspondiente a la IgG3. En el caso de los genes V de las cadenas pesadas, al igual que hemos visto en las cadenas ligeras, junto a cada segmento génico se encuentran los segmentos líder (L).
Segmentos líder y promotores
Los segmentos líder codifican un péptido pequeño que servirá de guía tanto para las cadenas ligeras como pesadas a su paso por el retículo endoplásmico pero que se separa de ellas antes de que las mismas se unan entre sí para formar la molécula completa.
Junto a estos segmentos génicos se sitúan otros conocidos como promotores y que son responsables de iniciar la señal del proceso de transcripción del DNA. Dentro de los promotores, se encuentran secuencias del DNA a las que se van a unir de manera específica ciertas proteínas nucleares conocidas como factores transcripcionales, que son las que van a regular su función.
Debido a la complejidad de estos procesos de recombinación, han de tener necesariamente un mecanismo de regulación muy estricto, no solo para los genes de las Igs sino también para los genes del TCR, en el que sabemos que participan los genes RAG-1 y RAG-2 (genes activadores de la recombinación 1 y 2).
Fenómenos de aproximación de regiones
Para el proceso de reordenamiento génico, se deberán juntar los segmentos de genes que formarán la estructura de las futuras cadenas ligeras y pesadas. Este acercamiento implica la formación de un bucle en la estructura espacial del DNA, de manera que se aproximan las partes por donde se producirá el corte (Figura: Eliminación).
Cambio de isotipo de las inmunoglobulinas.
Cuando los linfocitos B reconocen al antígeno y se activan, las células plasmáticas formadas producen IgM, dando lugar a la respuesta primaria. Si el estímulo persiste, otras células pueden comenzar a producir IgG, IgA e IgE. Esto quiere decir que las células B tienen la propiedad de ajustar el isotipo de las inmunoglobulinas que producen. Por tanto, en la respuesta a un mismo antígeno se van a generar anticuerpos que van a mantener su parte variable, pero van a ser diferentes en los segmentos constantes que van a ensamblar, dando lugar a varios isotipos.
Uno de los mecanismos que pueden intervenir en este fenómeno es el conocido como de splicing alternativo, así una las líneas celulares B, pueden cambiar de isotopo de Ig (Figura: splicing alternativo). Estos fenómenos pueden ser influenciados por ciertas citocinas, como es la IL-4.
Causas de diversidad de las Inmunoglobulinas
La diversidad de las inmunoglobulinas se debe a múltiples factores, entre ellos destacan:
1. La variabilidad de las cadenas ligeras y pesadas existentes. Como se sabe esto se debe al alto número de segmentos V, D y J existentes, y a la multiplicidad de formas de combinación tanto en cadenas pesadas como ligeras. Así, si consideramos que para la cadena pesada de las inmunoglobulinas del ratón existen unos 300 genes VH, 12 genes DH y 4 genes JH, las posibilidades de combinación diferentes son como mínimo de (300x12x4) =1.4x104. A esto hay que añadir las provenientes de las cadenas ligeras que para una sola cadena puede ser del orden 1.2x103. Por otra parte, al necesitar la unión de cadenas pesada y ligera, las posibilidades combinatorias son las resultantes de multiplicar los valores obtenidos del cálculo de variabilidad de cada una de las cadenas.
2. Otro generador de diversidad es la imprecisión de las uniones de los segmentos V, D y J debido posiblemente a desequilibrios en la unión entre los intrones y exones correspondientes.
3. Además, la diversidad puede verse amplificada por la aparición de mutaciones puntuales en el gen responsable de una determinada cadena de inmunoglobulinas. La presencia de hipermutaciones somáticas como vía de generación de diversidad se ha demostrado al encontrarse cadenas de Igs que, obtenidas del mismo tipo de mieloma, poseían secuencias de aminoácidos ligeramente diferentes a pesar de estar codificadas por un mismo gen. Hoy sabemos, además, que este tipo de mutaciones somáticas son de gran importancia en el aumento de afinidad del anticuerpo al antígeno. Efectivamente sabemos que conforme se produce en el tiempo la respuesta de inmunoglobulinas, ésta no sólo incrementa el número de moléculas producidas, sino que igualmente lo hace de la afinidad de las mismas con sus antígenos.
Exclusión alélica en la síntesis de Inmunoglobulinas
 Cada célula productora de anticuerpos sólo expresa un tipo de cadena pesada y de cadena ligera. Este fenómeno se produce a pesar de que los genes que codifican estas cadenas se encuentran presentes tanto en el cromosoma de origen paterno como materno. Es decir, a pesar de que existan dos copias para cada una de las cadenas pesadas y ligeras, sólo una es expresada. De no ser así se generaría un serio problema en el individuo porque una misma célula podría producir anticuerpos con especificidades diferentes.
Cada célula productora de anticuerpos sólo expresa un tipo de cadena pesada y de cadena ligera. Este fenómeno se produce a pesar de que los genes que codifican estas cadenas se encuentran presentes tanto en el cromosoma de origen paterno como materno. Es decir, a pesar de que existan dos copias para cada una de las cadenas pesadas y ligeras, sólo una es expresada. De no ser así se generaría un serio problema en el individuo porque una misma célula podría producir anticuerpos con especificidades diferentes.
Este fenómeno se conoce como exclusión alélica y se debe a que una vez que se ha producido una unión productiva V/D/J, los procesos de recombinación son bruscamente detenidos en el otro cromosoma.
Fases finales de las síntesis de Inmunoglobulinas
El RNAm codificante de las cadenas de Igs abandonará el núcleo para alcanzar los ribosomas en donde se producirá la síntesis de los péptidos mediante el proceso de traducción (figura: secreción de Igs).
En el proceso de traducción en los ribosomas se sintetizan los péptidos, que después se glicosilan y se ensamblan para la formación de la inmunoglobulina completa. Una vez que se ha producido el ensamblaje de la inmunoglobulina, éstas tienen dos opciones. Una es la de permanecer anclada en la membrana de las células B, convirtiéndo de esta forma en el receptor de estas células B para el antígeno. La otra es la de ser secretada al medio exterior celular con la función de interaccionar con los antígenos y conseguir su neutralización o en su caso su destrucción.
La única diferencia entre ambas es que las formas de Igs de membrana tienen además un péptido añadido que le vale para unirse a la membrana.
Anticuerpos monoclonales
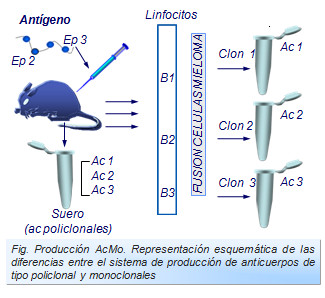
Cuando un antígeno induce la producción de anticuerpos se forman una gran variabilidad de éstos frente a cada uno de los diferentes epítopos del antígeno. Por ello decimos que estos anticuerpos son policlonales debido a que son muchos y muy diversos clones linfocitarios los que se activan y diferencian (Figura: Producción AcMo). Este fenómeno es de gran utilidad biológica ya que ofrecen una amplia barrera de protección del organismo.
Sin embargo, los antisueros así obtenidos, ofrecen serias dificultades para su uso en el laboratorio. Esto se debe a la gran heterogeneidad estructural y funcional que poseen. Este problema se ha solucionado desde que Georges Kholer y Cesar Milstein consiguieron la producción de anticuerpos monoespecíficos, conocidos como anticuerpos monoclonales(ACMo) (Figura: Cesar Milstein).
Con ello se abrió un amplio campo en Biología y Medicina puesto que estos anticuerpos son de gran utilidad debido a la capacidad de reconocer a tan solo uno de los epítopos de un antígeno. Veamos cómo se producen y después su utilidad.
Fundamentos de la producción de AcMo
El método seguido para la producción de estos anticuerpos consiste en la unión (fusión) de una célula B productora de anticuerpos, con una célula de gran capacidad de crecimiento (células tumoral de mieloma). Con ello se forma un híbrido (hibridoma) que posee la información genética necesaria para la síntesis del anticuerpo deseado, que le aporta la célula B, y una activa capacidad de síntesis proteica y de multiplicarse que le aporta las células del mieloma(Figura: Síntesis AcMo).
 De esta manera, se pueden producir innumerables tipos de hibridomas de acuerdo con el tipo de anticuerpo que interese. Al ser cada uno de los anticuerpos así producidos homogéneos, ofrecen patrones de reacción de gran especificidad con los antígenos utilizados en la inmunización.
De esta manera, se pueden producir innumerables tipos de hibridomas de acuerdo con el tipo de anticuerpo que interese. Al ser cada uno de los anticuerpos así producidos homogéneos, ofrecen patrones de reacción de gran especificidad con los antígenos utilizados en la inmunización.
De esta manera se pudieron desarrollar cultivos continuos de hibridomas que segregaban un anticuerpo monoclonal de especificidad predefinida. Una vez seleccionado el clon de hibridoma adecuado, éste puede conservarse largo tiempo congelado. En cualquier momento el clon puede hacerse crecer para la producción de anticuerpos por inyección a ratones o siembra en cultivo. Cuando el clon se inyecta se hace intraperitonealmente con lo que genera una ascitis extraordinariamente rica en anticuerpos, que son fácilmente purificables. Cuando el clon se ha cultivado in vitro el anticuerpo se recolecta a partir del sobrenadante del cultivo.
Tecnología de la obtención de AcMo
 Generalmente se comienza por inmunizar a ratones con el antígeno frente al cual se desea obtener el anticuerpo. Comprobada la presencia de anticuerpos se procede al aislamiento de las células B productoras de los mismos del bazo de los animales, en condiciones de esterilidad.
Generalmente se comienza por inmunizar a ratones con el antígeno frente al cual se desea obtener el anticuerpo. Comprobada la presencia de anticuerpos se procede al aislamiento de las células B productoras de los mismos del bazo de los animales, en condiciones de esterilidad.
La fusión celular entre el bazo del ratón inmunizado y la línea mielomatosa se realiza en presencia de polietilenglicol (PEG), que es un detergente capaz de disolver parte de las membranas celulares permitiendo así la formación de células que contienen dos núcleos. Posteriormente se procede a la selección de los híbridos.
Terminado este proceso se estudian los sobrenadantes de los híbridos para determinar si producen anticuerpos. Los hibridomas productores de anticuerpos se expanden y si siguen siendo positivos se clonan cuando se estabiliza el cultivo. La clonación tiene como objetivo aislar el hibridoma productor del anticuerpo deseado. Después y dado que los hibridomas productores de anticuerpos se encuentran mezclados se procede a su aislamiento, para lo cual se diluyen y dispensan en tubos distintos en donde se calcula hay, al menos un solo hibridoma por pocillo. Después los hibridomas seleccionados se expanden para la producción de ACMo.
Utilidad de los anticuerpos monoclonales
Los ACMo, son de gran utilidad en múltiples circunstancias. A continuación se relacionan algunas de ellas.
• En la caracterización y cuantificación de sustancias de interés biológico que se encuentran en cantidades muy pequeñas, tales como hormonas, enzimas, interferones, etc. (Tabla: Utilidad de los AcMo).
• En la identificación de antígenos presentes en las membranas celulares, como son las moléculas CD3, CD4, CD8 y otras muchas. Esto ha permitido no solamente la cuantificación de subpoblaciones celulares, sino también su fraccionamiento y aislamiento.
• En trasplantes de órganos y enfermedades autoinmunes en donde los AcMo dirigidos contra los linfocitos T se utilizan frecuentemente en casos de amenaza de rechazo agudo.
• En oncología para la localización de células tumorales y/o su destrucción. Para ello los anticuerpos monoclonales específicos frente a antígenos tumorales tales como el antígeno carcinoembrionario pueden ser marcados con sustancias radioactivas, como por ejemplo In111 o Tc99. De esta manera es posible localizar su situación en el organismo mediante una gamma cámara especial cuando son administrados a individuos afectados por tumores. También los AcMo pueden ser utilizados en la destrucción de células tumorales en oncología, para lo cual los anticuerpos son marcados con drogas citostáticas y citotóxicas antes de su administración.
AcMo quiméricos humanizados
Al ser los AcMo en su mayoría de origen murino, cuando sse administran a individuos, éstos pueden producir anticuerpos frente a los mismos, lo que hace que disminuya su eficacia o incluso aparezcan problemas de tipo alérgico cuando se usan de manera reiterada.
Sin embargo, sería deseable que, para su aplicación terapéutica, los anticuerpos procedieron de linfocitos humanos y no de ratón o rata. Contrariamente a lo que se esperaba en un comienzo, la utilización de linfocitos humanos ha resultado difícil, en tanto que los intentos de inmortalizar hibridomas humanos mediante su fusión con células de mielomas de ratón o rata, han sido, hasta la fecha, decepcionantes.
El problema reside en que, cuando se fusionan células humanas con células animales, hay una rápida pérdida preferencial de los cromosomas humanos en las células híbridas resultantes. En la actualidad se comienza a producir AcMo humanos empleando linfocitos B a los que se transforma en tumorales mediante su infección con el virus de Epstein Barr, obteniéndose así linfocitos B productores de AcMo que pueden ser clonados y, por consiguiente, anticuerpos monoclonales homogéneos en su composición y especificidad (Figura: Hibridoma).
Para evitar este problema se están ya obteniendo mediante técnicas de ingeniería genética anticuerpos humanizados de tipo quimérico. Estos anticuerpos se preparan mediante la creación de una molécula híbrida en la que se mantienen las partes del anticuerpo monoclonal de ratón que le confieren la especificidad (regiones V, D y J), y sustituir la región constante del anticuerpo de ratón por una región igualmente constante del mismo isotipo pero de procedencia humana.
De acuerdo con esto, es posible eliminar de un anticuerpo de ratón (al menos parcialmente) sus regiones más inmunógenas, de manera que no sea reconocido como extraño por el organismo de la persona a la que se inyecta(Figura: AcMo quiméricos). Un paso más adelante en la humanización de los anticuerpos monoclonales producidos en ratón ha sido dado mediante la realización de los llamados anticuerpos hiper quiméricos.
Bibliografía
Davies, DR and Chacko, S: Antibody structure. Acc. Chem. Res. 1993, 26:421-427.
Edmundson, A.B. Guddat, L.W. Shan, L. Fan, Z.C. Hanson, B.L. (1994): Structural aspects of conformational changes in ligand binding by antibody fragments. Research in Immunology. 145:56-61.
Faber, C. Shan, L Fan, Z. Guddat, L.W. Furebring, C. Ohlin, M. Borrebaeck, C.A.K. and Edmundson A.B. (1998): Three dimensional structure of a human Fab with high affinity for tetanus toxoid. Immunotech. 3:253-270.
Fields, B.A. Goldbaum, F.A. Yserm, X. Poljak, R.J. and Maruzza, R.A. (1995): Molecular basis of antigen mimicry by an anti-idiotipe. Nature. 374:739-742.
Harris, L.J. Larson, S.B. Hasel, K.W. Day, J. Greenwod, A. and McPherson, A (1992): The three-dimensional structure of an intact monoclonal antibody for canine lymphoma. Nature. 360:369-372.
Ros, R. Schwesinger, F. Anselmetti, D. Kubon, M. Schafer, R. Pluckthun, A. and Tiefenauer, L. (1998): Antigen binding forces of individually addressed single chain antibody molecules. Proc. Natl. Acad. Sci. USA. 95:7402-7405.