04. MOLÉCULAS DE HISTOCOMPATIBILIDAD
Las moléculas de histocompatibilidad, que en humanos se denominan moléculas HLA, fueron inicialmente descubiertas por Jean Dausset, debido a su participación en el rechazo de tejidos y órganos trasplantados.
Hoy conocemos miles de moléculas HLA gracias al trabajo de los laboratorios de inmunología y a la colaboración entre los mismos a través de los Workshops Internacionales de Histocompatibilidad que desde mediados del siglo XX se celebran cada dos años en distintos lugares del mundo. Sin embargo, hoy sabemos que estas moléculas tienen funciones mucho más amplias, entre las que se incluyen, el permitir que se lleve a cabo la respuesta inmune, sin lo cual no sería posible la defensa de los organismos frente al ataque de agentes extraños. Estas moléculas se encuentran en la membrana de la mayoría de las células del organismo, y por ser muy variables de unos individuos a otros contribuyen a la diversidad biológica de la especie humana.

¿Cuál es la estructura de las moléculas HLA?
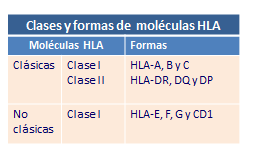
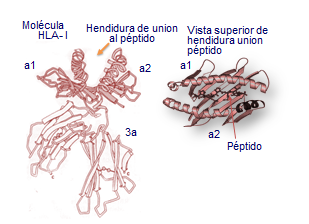
Estas moléculas se encuentran insertas en las membranas celulares, están formadas por dos glicoproteínas unidas entre sí por interacciones de naturaleza no covalente, se organizan en dominios al igual que las inmunoglobulinas y son de dos tipos clase I y clase II (Tabla: Clases y formas de HLA).
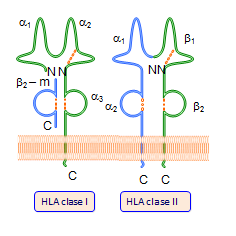
La parte extracelular de la cadena pesada posee tres dominios, α-1, α-2 y α-3. Los α-1 y α-2 conforman la hendidura o sitio de unión a los péptidos y tienen una composición muy variable en aminoácidos, mientras que el dominio α-3 es muy constante (Figura: Variabilidad HLA).
Las moléculas de histocompatibilidad clase I se encuentran en la mayoría de las células del organismo, mientras que las de clase II, lo hacen sólo en las células inmunocompetentes.
¿Cuáles son las funciones de las moléculas HLA?
Obviamente las moléculas HLA no están ahí para complicar la evolución humana, por ejemplo interfiriendo en la realización de trasplantes, aspecto éste por el que fueron descubiertas estas moléculas. Muy por el contrario, este complejo génico y las moléculas HLA, poseen importantes funciones en la defensa de los organismos frente a sustancias extrañas, colaborando en hacer posible su identificación correcta como algo distinto de lo propio.
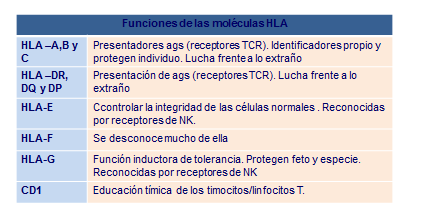
células de cada organismo, posee la propiedad de presentar péptidos antigénicos para la activación de los linfocitos T. Cuando la presentación de estos péptidos se hace por moléculas clase I, se activan mayoritariamente los linfocitos T citotóxicos, Cuando la presentación se hace por moléculas clase II se activan mayoritariamente los linfocitos T colaboradores (Tabla: Funciones HLA).
Además, las moléculas de clase I actúan como marcadores de lo propio, mientras que las moléculas de clase II tienen prioritariamente la función de presentar antígenos a los linfocitos T. De ahí que las moléculas de clase I se encuentren todas las células nucleadas del organismo, de tal manera que si en algún momento pierden estas moléculas, son destruidas por el sistema inmune mientras que las considera como no propias. Solo de esta regla se salvan los glóbulos rojos, que pueden sobrevivir a pesar de no expresar moléculas HLA.

Moléculas de HLA clase I no clásicas
Además de las moléculas HLA clásicas, existe otro grupo de moléculas de histocompatibilidad clase I no clásicas, HLA-G, HLA-E y CD1, que se caracterizan por ser muy poco polimorfas.
Las moléculas HLA-E se encuentran en la mayoría de las células del organismo y su función es la de inhibir las células NK. De esta esta manera se protegen de su destrucción las células del organismo, que expresan HLA-E.
Las moléculas HLA-G poseen función inmunoreguladora y están estrechamente vinculadas a los procesos de tolerancia inmunológica. Se encuentran sólo en el trofoblasto fetal donde actúan inhibiendo el sistema inmune de la madre protegiendo al feto durante el embarazo de las defensas maternas. Hemos de considerar que el feto es equivalente a un trasplante, debido al contenido paterno presente en el mismo. Recientemente se ha demostrado también su efecto protector a la lisis en células infectadas por el virus del SIDA (HIV) trasplantes de corazón.
¿Cuáles son los genes de las moléculas HLA?
Estos genes se heredan de padres a hijos de acuerdo con las leyes de Mendel, como caracteres codominantes simples. Cada una de las combinaciones de genes de cada individuo presentes en cada uno de los cromosomas que los codifican, se conocen como haplotipo HLA. Cada célula del organismo, excepto las células germinales, posee un haplotipo que procede del padre y otro de la madre. Como la herencia de los haplotipos se hace en bloque en una familia determinada en la que el padre, por ejemplo, tiene los haplotipos (a) = A2, B8, Cw1, DR1 y (b) = A3, B7, Cw3, DR4 y la madre los haplotipos (c) = A2, B7, sólo Cw2, DR12 y (d) = A11, B13, Cw3, DR15, cada uno de los hijos podrán heredar cuatro combinaciones distintas de estos haplotipos: (a, c), (a, d), (b, c) y (b, d) (Figura: Herencia haplotipos).
Los genes HLA han demostrado que el polimorfismo a nivel genómico es mayor que el detectado a nivel serológico. Así por ejemplo existen numerosos subtipos de HLA‑A2 y numerosos subtipos de HLA‑B27. Para incluir estos subtipos se ha establecido un nuevo sistema de nomenclatura para los diferentes alelos HLA, añadiendo 2 dígitos más a la denominación de los 2 iniciales. Los dos primeros dígitos serían los de la especificidad serológica o genómica de baja resolución y los otros dos indicarían el subtipo de los anteriores y, como sólo se detecta a nivel genómico, se denomina genómico de alta resolución.
Polimorfismo HLA
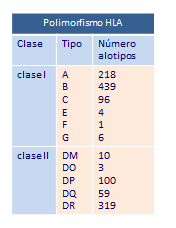
El complejo CMH, que posee diferentes loci y un número extraordinariamente grande de alelos diferentes, es por tanto, el complejo genético más poligénico y polimórfico que se conoce en vertebrados superiores. Hoy (año 2012), sabemos que existen 6.725 alelos para HLA clase I y 1.771 para clase II. Este enorme polimorfismo da como resultado una gran diversidad de moléculas de histocompatibilidad. (Tabla polimorfismo HLA)
Desequilibrio de ligamiento

a) Que los haplotipos con representación mayor en la población actual reflejarían las combinaciones de alelos presentes en los primeros miembros más ancestrales de una determinada población o comunidad (esto es por ejemplo lo que ocurre en la población india de americana).
b) Que los nuevos haplotipos HLA aparecen como consecuencia de los efectos del proceso evolutivo; por ejemplo, algunas combinaciones de alelos proporcionarían resistencia a ciertas enfermedades y harían que se seleccionen y estuvieran representadas en mayor frecuencia mientras que otros que podrían generar efectos perjudiciales no se seleccionarían o lo harían negativamente.
Factores inductores de polimorfismo
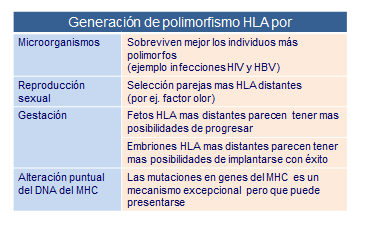
Probablemente uno de los mayores retos de la evolución de la especie humana haya sido la generación de su biodiversidad. A su vez, esta biodiversidad ha permitido la supervivencia de aquellos individuos cuya peculiaridades diferenciales les ha dado mayores posibilidades de sobreponerse frente a las múltiples adversidades con las que se han encontrado a lo largo de la evolución. Por ejemplo en la actualidad existen un 2% cierto de individuos que son residentes a contraer la infección con el VIH. Es evidente, que esta población resistente dejará mayor descendencia en las zonas donde el SIDA es un azote que aquellas otras personas que poseen mayor facilidad a infectarse por dicho virus.
La mezcla de genes, como ocurre en reproducción sexual en humanos, es el principal factor inductor de variabilidad HLA. Máxime cuando, se ha denostado, que cada persona elige inconscientemente como pareja a otra persona que posee genes HLA diferentes a los propios. De esta manera los hijos heredan de cada uno de sus padres la mitad de sus genes codificadores de estas moléculas HLA. Los fetos con genes HLA más distintos a los maternos tienen más posibilidades de crecer, mientras que aquellos más idénticos tienen más riesgo de terminar en abortos.
Polimorfismo HLA y biodiversidad humana
<!- Debido a la complejidad de esta función, existen mecanismos muy precisos de control que evitan que sea el sistema inmune el que destruya los componentes propios del organismo donde se asienta. Sin embargo, la biología humana no está exenta de fallos, apareciendo así en ciertos casos enfermedades, conocidas como de autoinmunidad, comentadas con antelación, en las que el sistema inmune falla en estos sistemas de reconocimiento y pierde la tolerancia que debe mantener frente a los componentes propios.
De la misma manera en que todos los miembros de una especie cuentan con componentes idénticos como son las hormonas, también cuentan con unos componentes muy variables denominados “moléculas de histocompatibilidad” que son diferentes de unos individuos a otros incluso dentro de la misma especie y en consecuencia, en base a los conocimientos que se tiene actualmente, se les puede considerar como los verdaderos “marcadores de lo propio de cada individuo”
<!- Estas moléculas actúan a modo de “código de barras biológico” o "carnet de identidad biológico" que si bien, se transmite de padres a hijos, haciendo que cada uno de nosotros seamos únicos e irrepetibles. Ello se debe al alto número de moléculas de histocompatibilidad existente dado su alto polimorfismo y diversidad que se puede generar adicionalmente por mutaciones espontáneas. Así pues, podemos decir que la especie humana es biológicamente diversa al estar formada por individuos que a su vez son biológicamente únicos.
¿Cómo se procesan y se presentan los péptidos?
Como se ha dicho con anterioridad, la principal función de las moléculas HLA es la de presentar péptidos extraños a las células inmunocompetentes. Las moléculas HLA y el péptido que transportan son reconocidos por el receptor de las células T, pero solo, según demostraron Zinkernagel y Doherty, cuando las moléculas HLA transportadoras son del mismo individuo en donde está ocurriendo este proceso.
Las células que exponen los péptidos unidos a moléculas HLA- II, se conocen como células presentadoras de antígenos (APC), mientras que aquellas que lo hacen unidos a moléculas de HLA-I, se conocen como células diana o célula blanco. En el primer caso, lo que se produce es una estimulación de linfocitos Th en el inicio de la respuesta inmune, mientras que en el segundo caso se activan los linfocitos Tc relacionados con los fenómenos citotóxicos al final de la respuesta. Veamos estos procesos:
Procesamiento de antígenos por células APC
Las células APC, portadoras de las moléculas HLA-II, tienen que capturar del medio exterior los antígenos y fraccionarlos (procesarlos) en su interior hasta su degradación en péptidos antes de ser presentados por las moléculas de HLA-II. Los tres tipos celulares que cumplen estos requisitos son las células dendríticas, los macrófagos y los linfocitos B.
La incorporación de antígenos del medio externo se realiza mediante pinocitosis o fagocitosis, según el tipo de partícula y célula. El fagosoma formado, se fusiona con lisosomas constituyendo un fagolisosoma, que es donde se produce la degradación de los antígenos en péptidos debido a al bajo pH y a la presencia de proteasas.
La biosíntesis de las moléculas HLA-II se realiza en el retículo endoplasmático de tal manera que una vez formadas, a ellas se unen otras moléculas, las cadenas invariables (Ii). El complejo formado posteriormente se traslada al aparato de Golgi desde donde se desvían a otra parte de la vía endocítica denominado compartimento de clase II (MIIC). Aquí se inicia la proteólisis parcial de la cadena Ii, quedándose sólo que unida a la molécula HLA-I la porción de Ii que ocupa la hendidura de unión a los péptidos, llamada cadena asociada a péptidos (CLIP). El CLIP se separa posteriormente, pero el dímero se mantiene estable gracias a la intervención de una chaperona, el HLA-DM (Figura 6).
Después, las moléculas HLA-II se separan de HLA-DM si se asocia a un péptido capaz de conferirle suficiente estabilidad y por último, el complejo estable HLA-II/péptido viaja a la superficie celular de la APC por vía vesicular (Figura: Procesamiento APC).
Procesamiento de antígenos por células blanco
Las células que utilizan las moléculas HLA clase I, se caracterizan por presentar péptidos procedentes del procesamiento de proteínas ya presentes dentro de la célula. Estos péptidos pueden provenir de proteínas virales o de proteínas tumorales entre otros. De ahí que en este caso se activen los linfocitos Tc, fenómeno que conduce a la destrucción de dichas células. Veamos estos procesos con detalle.
La biosíntesis de moléculas HLA clase I, se realiza en el retículo endoplasmático (RE) en donde el heterodímero formado por la cadena pesada y la beta-2-m es inestable en condiciones fisiológicas. Por ello requiere unirse a una molécula llamada calnexina, que actúa como chaperona de HLA-I, manteniendo su estructura espacial. Después la beta-2-m se une a la cadena pesada y la calnexina se desplaza para que HLA-I se una a otras chaperonas, como la calreticulina. El complejo calreticulina/beta-2-m se une a una tercera chaperona llamada tapasina (Figura Procesamiento célula diana).
Por otra parte, las proteínas endógenas son degradas en los proteosomas celulares en donde las proteínas son degradadas hasta péptidos que posteriormente serán trasladados al interior del RE con ayuda del transportador asociado de péptidos (TAP). Posteriormente las moléculas HLA-I, estabilizadas por los pépidos unidos a ellas, son transportadas a la membrana celular donde quedan ancladas exponiéndose a los receptores de los linfocitos Tc.
¿Cómo se unen los péptidos a moléculas HLA?
En estado de reposo celular, las moléculas del HLA están ocupadas por péptidos propios, endógenas o exógenas, pero cuando el organismo es atacado por un agente extraño, por ejemplo un virus, estos péptidos naturales son desplazados por los péptidos virales.
Debido al polimorfismo de las moléculas del HLA, cada molécula de histocompatibilidad presenta una secuencia de aminoácidos distinta en el lugar de unión al péptido. Esto implica que existen preferencias en cuanto al patrón de péptidos que se unirán a cada una de las moléculas de HLA (Figura 7).Las moléculas de clase I unen péptidos cortos, de 8-10 aa, y cada una de las moléculas puede unir 5.000 péptidos distintos que se unen a la cavidad de la molécula HLA por los aminoácidos en posición 2 y 9 del péptido que son los "puntos de anclaje" (Tabla 6.1).
Las moléculas de clase II, unen péptidos de mayor tamaño que las de clase I, oscilan entre 12 y 20 aa y sus puntos de anclaje a la cavidad del HLA se hace por los aminoácidos situados en las posiciones extremas de los péptidos.
¿Por qué y cómo se analizan las moléculas HLA en la clínica?
En múltiples circunstancias se hace necesario analizar en el laboratorio clínico muestras humanas para conocer el tipo de moléculas HLA o los genes que las codifican. Cuando se quiere confirmar un diagnóstico de un paciente que se sospecha sufre una determinada enfermedad o patología asociada a la presencia de determinados tipos de estas moléculas; en trasplantes de órganos sólidos y médula ósea para encontrar la máxima igualdad de moléculas HLA, compatibilidad HLA, entre donantes y receptores y evitar así el rechazo en el futuro; en estudios de filiación familiar ya que al ser los genes humanas de mayor polimorfismo, mediante su análisis se pueden analizar relaciones familiares entre padres e hijos.
Al análisis que se realiza en el Laboratorio de Inmunología para conocer el tipo de moléculas de histocompatibilidad o sus alelos de un determinado individuo, se le denomina tipaje HLA. Este tipaje se hace utilizando bien métodos serológicos o de biología molecular (genéticos), ó ambos si se requiere (Figura Tipaje HLA).
El método serológico, se realiza para identificar los tipos de molécula HLA presentes en las membranas celulares de los linfocitos, siendo el método más utilizado el test de microlinfocitotoxicidad mediada por complemento. Éste se realiza enfrentando a los linfocitos a estudiar a una batería de anticuerpos monoclonales específicos para cada una de las moléculas HLA posibles. Posteriormente se añade complemento de tal manera que en los pocillos en los que se encuentren los anticuerpos específicos con las moléculas HLA de un individuo determinado, se producirá lisis celular que es visualizada al microscopio. Para identificar las células muertas y vivas, se usan los fluorocromos naranja de acridina y bromuro de etidio. El primero, tiñe a las células de rojo, y nos indica cuales están muertas ya que se fija al ADN y el segundo tiñe las células vivas de color verde brillante (Figura Tipaje serológico).
El estudio de HLA clase II, no se suele hacer por métodos serológicos pues requiere separar a los linfocito B del resto de linfocitos, es por ello que se acude a métodos basado en biología molecular.
Las técnicas de biología molecular más usadas para el tipaje requieren en primer lugar amplificar un segmento de ADN por la técnica de reacción en cadena de la polimerasa (PCR) (Figura Tipaje por biología molecular).
Asociación entre HLA y enfermedad
El extraordinario polimorfismo de las moléculas HLA y sus genes está ayudando a comprender por qué unas personas desarrollan unas enfermedades y otras no. Además estos conocimientos están siendo una importante herramienta para el estudio genético de gran utilidad en biología y en medicina.
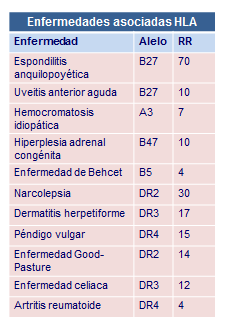
Así, desde hace varias décadas se sabe que el padecimiento de ciertas enfermedades se asocia con el incremento en la frecuencia de un determinado alelo HLA. Esta asociación cuando tiene un valor estadísticamente significativo, se viene considerando como un factor de susceptibilidad o un marcador de riesgo a padecer una determinada enfermedad. Esto puede cifrarse estadísticamente como “riesgo relativo” (RR) y da una idea de la mayor o menor probabilidad que tiene un sujeto a padecer una determinada enfermedad si presenta dicho marcador o alelo HLA con respecto a aquellos individuos que no lo tienen (Tabla Enfermedades asociadas)